
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:
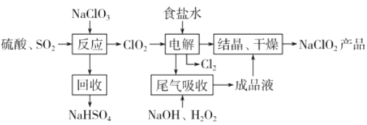
己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。
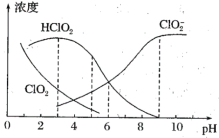
①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
【答案】2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O 反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能 用38℃—60℃的温水洗涤 90.5% 5ClO2-+ 4H+ =4ClO2 + Cl- + 2H2O c(HClO2) > c(ClO2-) > c(ClO2) > c(Cl-)
【解析】
⑴根据氧化还原反应原理写出新方法制备,由于浓度较大会发生爆炸,因此新方法中二氧化碳对ClO2有稀释作用,降低了浓度,避免安全事故。
⑵由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,因此避免低于用38℃以下的水,且不能高于60℃的温水洗涤。
⑶根据方程式建立NaClO2与Na2S2O3关系,列出方程,计算12.5g中NaClO2的物质的量,再计算纯度。
⑷由于ClO2-自身发生氧化还原,根据氧化还原反应原理写出离子方程式,再根据图像得出微粒的浓度大小,还要根据方程式得出c(ClO2)和c(Cl-)的大小。
⑴根据氧化还原反应原理得出该方法的化学方程式为2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O,反应生成了CO2和ClO2,CO2对ClO2起到了稀释作用,提高了生产的安全性能,因此该新方法最突出的优点是反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能,故答案为:2NaClO3 +H2C2O4+H2SO4 = 2ClO2↑+CO2↑+2H2O;反应中生成的CO2对ClO2起到了稀释作用,提高了生产的安全性能。
⑵由于NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,因此用38℃—60℃的温水洗涤,故答案为:用38℃—60℃的温水洗涤。
⑶根据方程式得出关系
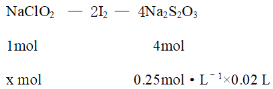
![]()
解得x = 0.00125mol,则12.5g样品中NaClO2的物质的量0.00125mol×100 = 0.125 mol,其产品NaClO2的纯度![]() ,故答案为:90.5%。
,故答案为:90.5%。
⑷①酸性条件下NaClO2溶液要发生自身氧化还原反应生成Cl-和ClO2,其用离子方程式为5ClO2-+ 4H+ =4ClO2 + Cl-+ 2H2O,故答案为:5ClO2-+ 4H+ =4ClO2 + Cl-+ 2H2O。
②pH=5时,根据图像可以得出NaClO2溶液中c(HClO2) > c(ClO2-) > c(ClO2),根据第①问在酸性条件下得到ClO2和Cl-的比例关系,c(Cl-) < c(ClO2),因此四种含氯微粒的浓度由大到小的顺序是c(HClO2) > c(ClO2-) > c(ClO2) > c(Cl-)。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:
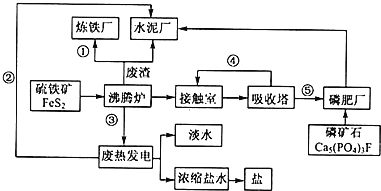
(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:

下列说法正确的是①滤液A中的阳离子为Fe2+、Fe3+、H+ ;②样品中氧元素的物质的量为0.03 mol;③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol;④V=224;⑤V=336。
A. ①③④ B. ②③④ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用1.0mol·L-1的NaOH溶液中和某浓度的H2SO4溶液,所得溶液的pH和所用NaOH溶液体积的关系如图所示,则原H2SO4溶液的物质的量浓度及完全反应后溶液的体积(忽略反应前后溶液体积的变化)分别是( )
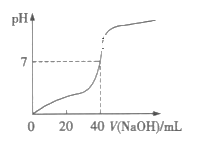
A.1.0mol·L-1,20mLB.0.5mol·L-1,40mL
C.0.5mol·L-1,80mLD.1.0mol·L-1,80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是( )
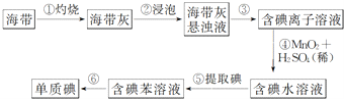
A. 步骤①需要用到蒸发皿 B. 步骤③需要过滤装置
C. 步骤⑤需要用到分液漏斗 D. 步骤⑥需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。下列有关说法正确的是( )
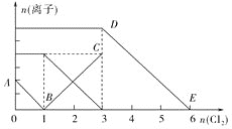
A.线段AB代表Fe2+物质的量的变化情况
B.线段BC代表Fe3+物质的量的变化情况
C.线段DE所发生的离子反应方程式为2Fe2++Cl2===2Fe3++2Cl-
D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)
(2)反应③的ΔS__________0(填“>”、“<”);反应③的ΔH__________0(填“>”、“<”)
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正__________V逆(填“>”、“=”或“<”)
Ⅱ.一定条件下,在容积为2L的密闭容器中充入lmolCO与2molH2合成甲醇,平衡转化率与温度、压强的关系如图所示:
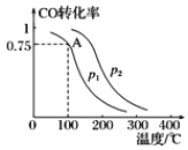
(1)p1__________p2(填“>”、“=”或“<”)。
(2)该反应达到平衡时,反应物转化率的关系是CO____________H2(填“>”、“=”或“<”)。
(3)若100℃P1时达平衡所用的时间为5min,则从开始到平衡这段时间用H2表示的速率为_______________________。
(4)该甲醇合成反应在A点的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是
A.m<n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com