
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
C
解析试题分析:A、溶于水或熔融状态下能够自身电离出离子的化合物是电解质,溶于水和熔融状态下都不能够自身电离出离子的化合物是非电解质。三氧化硫溶于水导电是由于三氧化硫与水反应生成的硫酸电离出离子而导电,硫酸是电解质,三氧化硫不能自身电离,是非电解质,A不正确;B、由于温度不变水的离子积常数不变,则温下将pH=4的醋酸溶液稀释后,溶液中OH-浓度增大,其余离子的浓度均降低,B不正确;C、由于S2-的水解程度强于HS-的水解程度,所以常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大,C正确;D、盐酸与氨水恰好反应时生成的氯化铵水解,溶液显酸性。所以当25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,说明反应中氨水是过量的,则V(氨水)>V(盐酸),D不正确,答案选C。
考点:考查电解质、醋酸稀释、溶液酸碱性以及酸碱中和反应的有关判断与计算


科目:高中化学 来源: 题型:单选题
下列有关结论中,正确的是
| A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低 |
| B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-) |
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成 |
| D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是
A.在A、B间的任意一点上都存在: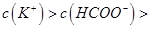

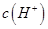
B.在B点:
 ,且a=7.5
,且a=7.5
C.在C点:
D.在D点:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,关于0.1 mol/L NaHY溶液,下列叙述正确的是( )
| A.将NaHY晶体加入水中一定能促进水的电离 |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c (Na+)>c (OH-)>c (H+)>c (HY-) |
| C.若溶液中c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c (Na+)>c (HY-)>c (H+)>c (Y2-)>c (H2Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
① pH=2和pH=1的HNO3中c(H+)之比为1∶10
②Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
③同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
④分别向100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中加入KOH,恰好中和所需的KOH一样多
| A.①④ | B.①③④ | C.①② | D.①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
| A.水可以电离出离子,所以是强电解质 |
| B.水的离子积可表示KW=c(H+)·c(OH-) |
| C.常温下水中的c(H+)大于c(OH-) |
| D.升高温度,c(H+)增大,显弱酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm处; |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 | B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 | D.溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是
| A.加入10mL 0.01mol·L-1的NaOH溶液 |
| B.加入10mL 的水进行稀释 |
| C.加水稀释成100mL |
| D.加入10mL 0.01mol·L-1的盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com