
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
科目:高中化学 来源: 题型:
正确掌握化学用语是学好化学的基础。下列化学用语中不正确的是
A.乙烯的结构简式CH2=CH2 B.CH4分子的球棍模型 
C.Ca2+ 的结构示意图  D.乙醇的分子式 C2H6O
D.乙醇的分子式 C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期 表中的相对
表中的相对 位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| Z | W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2∶3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
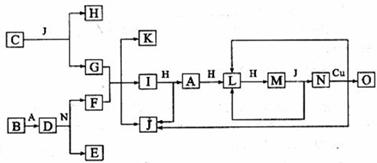
请回答下列问题:
(1)组成B单质的元素位于周期表第________周期,第________族。化合物C的电子式为________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:______________________。
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2 Cl+Cl ②Cl+H2
Cl+Cl ②Cl+H2 HCl+H ③H+Cl2
HCl+H ③H+Cl2 HCl+Cl……
HCl+Cl……
反应②中形成的化合物的电子式为__________________;反应③中被破坏的化学键属于__________________键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与相邻元素的原子半径从大到小的顺序是__________________ (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第__________________周期__________________族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是__________________。
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b.卤化氢的键长按H—F、H—Cl、H—Br、H—I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如下图。由图推断:
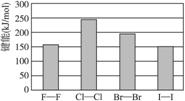
①非金属性强的卤素,其单质分子的化学键__________________断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
考生从两道化学题中各任选一题作答
1[化学——物质结构与性质]Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是___________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的_________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为_________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为_________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于_________(填晶体类型)。
 2[化学——有机化学基础]有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
2[化学——有机化学基础]有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:
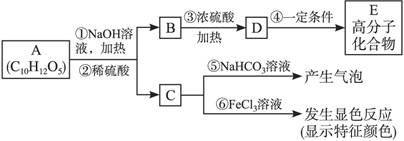
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: 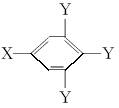 (其中:—X、—Y均为官能团
(其中:—X、—Y均为官能团 )。
)。
请回答下列问题:
(1)根据系统命名法,B的名称为________________。
(2)官能团—X的名称为____________,高聚物E的链节为____________。
(3)A的结构简式为________________________。
(4)反应⑤的化学方程式为____________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式。
ⅰ.含有苯环 ⅱ.能发生银镜反应 ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是____________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有_______种,金属性最强的元素与氧反应生成的化合物有______________(填两种化合物的化学式);
(2)属于稀有气体的是_________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是_______________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)____________;
(5)推测Si、N最简单氢化物的稳定性_________大于__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A.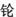 第七周期 B.镭 第七周期
第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com