
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_____________(填序号)。
a.Ba(OH)2溶液 b.BaCl2溶液 c.NaOH溶液 d.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____________(填“高于”、“低于”或“等于”)8.3,则甲判断正确。
(4)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离出的OH-浓度分别为a mol/L和b mol/L。则a:b=________。
(5)25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液。
①下列判断不正确的是________(填序号)。
a.两种溶液等体积混合后:3c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
b.两种溶液中存在的粒子种类不相同
c.两种溶液中c(H+)·c(OH-)=10-14
d.两种溶液中分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大
②等体积混合后溶液中离子浓度由大到小的顺序是:__________;
③常温下,等体积混合后的溶液中滴加稀盐酸至中性时,溶质的主要成分有:_______。
【答案】HCO3-+H2O![]() H2CO3+OH- 大于 乙 b 等于 10-4:1 ab c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) NaCl、NaHCO3、CO2(H2CO3)
H2CO3+OH- 大于 乙 b 等于 10-4:1 ab c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) NaCl、NaHCO3、CO2(H2CO3)
【解析】
碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性;碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度;NaHCO3和BaCl2不反应,但Na2CO3和BaCl2能反应生成白色沉淀BaCO3:Na2CO3+BaCl2=BaCO3↓+2NaCl,向Na2CO3或NaHCO3溶液中加入Ba(OH)2或氢氧化钙都生成白色沉淀BaCO3,向Na2CO3(不反应)溶液或NaHCO3(要反应)溶液中加入NaOH都不产生明显现象;在测得PH都等于9的NaOH溶液和Na2CO3溶液中,NaOH溶液由水电离的OH-浓度为a=10-9mol/L,Na2CO3溶液由水电离的OH-浓度为b=10-5mol/L;25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液两种溶液等体积混合后,存在物料守恒: 2c(Na+)=3 [c(HCO3-)+c(CO32-)+c(H2CO3)];NaHCO3和Na2CO3溶液中存在的微粒均为:碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同;温度不变,水的离子积常数不变;分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大;等体积混合后溶液显碱性,CO32-与HCO3-水解程度大于电离程度,CO32-水解会产生HCO3-;常温下,等体积混合后的溶液中滴加稀盐酸,NaCl显中性,H2CO3显酸性,NaHCO3显碱性。
(1)碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2OH2CO3+OH-;
故答案为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(2) 碳酸钠是强碱弱酸盐能水解,碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度;
故答案为:大于;
(3) ①NaHCO3和BaCl2不反应,但Na2CO3和BaCl2能反应生成白色沉淀BaCO3:Na2CO3+BaCl2=BaCO3↓+2NaCl,向Na2CO3或NaHCO3溶液中加入Ba(OH)2或氢氧化钙都生成白色沉淀BaCO3,向Na2CO3(不反应)溶液或NaHCO3(要反应)溶液中加入NaOH都不产生明显现象,②若加热后NaHCO3不分解,溶液仍然是NaHCO3溶液,温度不变溶液的PH值也不变,由此证明甲是正确的;
故答案为:乙;b;等于;
(4) 在测得PH都等于9的NaOH溶液和Na2CO3溶液中,NaOH溶液由水电离的OH-浓度为a=10-9mol/L,Na2CO3溶液由水电离的OH-浓度为b=10-5mol/L,则a:b=10-4:1;
故答案为:10-4:1;
(5) ①a.25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液两种溶液等体积混合后,存在物料守恒: 2c(Na+)=3 [c(HCO3-)+c(CO32-)+c(H2CO3)],故a错误;
b.NaHCO3和Na2CO3溶液中存在的微粒均为:碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故b错误;
c.温度不变,水的离子积常数不变,故c正确;
d.分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大,故d正确;
故答案选ab;
②等体积混合后溶液显碱性,CO32-与HCO3
③常温下,等体积混合后的溶液中滴加稀盐酸,在此过程中,HCO3-与H+生成水和CO2,CO32-与H+生成HCO3-、H2CO3,阴离子与Na+生成NaCl、NaHCO3,NaCl显中性,H2CO3显酸性,NaHCO3显碱性,故至中性时,溶质的主要成分有:NaCl、NaHCO3、CO2(H2CO3);
故答案为:ab;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);NaCl、NaHCO3、CO2(H2CO3)。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中存在Br2+H2O![]() HBr+HBrO,加入AgNO3溶液,溴水褪色
HBr+HBrO,加入AgNO3溶液,溴水褪色
B.对于平衡2SO2+O2![]() 2SO3,使用催化剂有利于SO3的合成
2SO3,使用催化剂有利于SO3的合成
C.醋酸稀溶液加热后溶液pH降低(不考虑醋酸受热挥发)
D.合成氨时适当增大压强有利于提高氮气的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
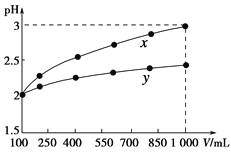
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
Ⅰ.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)写出H2O分子的电子式:________。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是________。
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
Ⅱ.胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、花卉上。
(3)写出铜原子价电子层的电子排布式:_____,与铜同一周期副族元素的基态原子中最外层电子数与铜原子相同的元素有________(填元素符号)。
(4)实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有________。
(5)实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为__________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
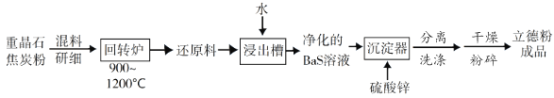
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为______________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的___________(填化学式)。
③沉淀器中反应的离子方程式为______________________。
(3)成品中S2的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.1000 mol·L1的I2KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1000 mol·L1Na2S2O3溶液滴定,反应式为I2+2![]() =2I+
=2I+![]() 。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为_________________,样品中S2的含量为______________(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成聚对苯二甲酸—1,4—丁二醇酯的合成路线图:

(1)实验室制备乙炔的方程式为______。
(2)化合物A的结构简式为______。
(3)③的反应类型为______。
(4)写出反应⑥的化学方程式______。
(5)D有多种同分异构体,符合以下条件的共有______种,写出其中一种同分异构体的结构简式______。
①能发生水解反应,遇饱和FeCl3溶液显色;
②1mol该同分异构体能与足量银氨溶液生成4mol Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
(2)某有机物含C、H、O三种元素,分子模型如图所示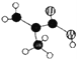 (图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中![]() =1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
(4)25℃时,已知Ksp[Fe(OH)3]=8×10-38,则0.01mol/L FeCl3溶液中欲使Fe3+沉淀,求溶液所需的最小pH=________。(用对数形式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com