
【题目】下列气体中不会造成空气污染的是( )
A.NOB.NO2C.CO2D.SO2
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
⑤已知常温下弱电解质的电离平衡常数如下:一水合氨Kb=1.8×10-5,戊:Ka1=1.3×10-2, Ka2 = 6.3×10 -8。若一水合氨与丁恰好完全反应生成正盐,则浓度为0.1 mol/L的该正盐溶液呈____性(填“酸”或“碱”或“中”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____2(填“>”“<”或“=”)。
____2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,CrO42和Cr2O72在溶液中可相互转化,K2Cr2O7溶液中存在平衡:Cr2O![]() (橙色)+H2O
(橙色)+H2O![]() 2CrO
2CrO![]() (黄色)+2H+ 回答下列问题:
(黄色)+2H+ 回答下列问题:
(1)CrO42和Cr2O72在溶液中可相互转化,用K2Cr2O7溶液进行下列实验:

结合实验,下列说法正确的是________
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O![]() 被C2H5OH氧化
被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
(2)室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_____0 (填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl 恰好完全沉淀(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述不正确的是( )
A. 氧化性:ClO->I2>SO42—
B. 蓝色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2使淀粉变蓝
D. 若将Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

(1)写出基态Cu原子的核外电子排布式____________________。
(2)写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)_________________。
II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的外围电子排布式________。
(2)根据元素周期律,原子半径Ga_______As,第一电离能Ga______As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为_______,其中As的杂化轨道类型为________。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是__________________。
(5)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以___________键键合。Ga和As的摩尔质量分别为M1 g·mol-1和M2 g·mol-1,原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________________________(列出含ρ和NA的计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层数;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为______,Y的轨道表示式为______ 。
(2)ZX2的分子式是_______,YX2电子式是______ 。
(3)Z形成的简单阴离子的结构示意图是_______ 。
(4)Y和Z一定条件下形成简单分子的结构式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以制备无水氯化铁。下列有关说法正确的是( )
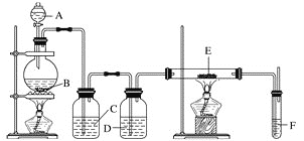
A. 烧瓶B中制备氯气的反应物为MnO2和稀盐酸
B. 装置C、D中分别盛有浓硫酸、饱和食盐水
C. 装置E和装置F之间需要增加一个干燥装置,才能制得无水氯化铁
D. 装置F的目的是检验有无氯气逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com