
【题目】冶炼金属常用以下几种方法:
①用碳、一氧化碳或氢气做还原剂还原;
②用较活泼金属钠、镁等还原;
③电解法;
④热分解法。
选用最佳方法将下列金属从其化合物中还原出来:
(1)铁、锌、铜等中等活泼金属________。
(2)钠、镁、铝等活泼或较活泼金属________。
(3)汞、银等不活泼金属________。
(4)钾、铷、铯、钛等金属通常还原方法是________。
【答案】① ③ ④ ②
【解析】
(1)由Fe、Zn、Cu等中等活泼金属用热还原法;
(2)Na、Mg、Al等活泼或较活泼金属的化合物与C、CO或H2等不反应;
(3)Hg、Ag等不活泼金属的氧化物不稳定,受热易分解;
(4)金属钾的制备反应为Na+KCl![]() NaCl+K↑,不是用活泼金属置换不活泼金属;钛是用钠或镁来置换。
NaCl+K↑,不是用活泼金属置换不活泼金属;钛是用钠或镁来置换。
(1)由Fe、Zn、Cu等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼,故答案为①;
(2)Na、Mg、Al等活泼或较活泼金属的化合物与C、CO或H2等不反应,故采用电解法冶炼制备,故答案为③;
(3)Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,故采用热分解法冶炼,故答案为④;
(4)金属钾的制备反应为Na+KCl![]() NaCl+K↑,不是用活泼金属置换不活泼金属,而是应用平衡原理,不断的抽离钾蒸气使反应持续进行;钛是用钠或镁来置换:4Na+TiCl4
NaCl+K↑,不是用活泼金属置换不活泼金属,而是应用平衡原理,不断的抽离钾蒸气使反应持续进行;钛是用钠或镁来置换:4Na+TiCl4![]() 4NaCl+Ti或2Mg+TiCl4
4NaCl+Ti或2Mg+TiCl4![]() 2MgCl2+Ti。
2MgCl2+Ti。
答案选②。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】常温下用aLpH=3的HX溶液与bLpH=11的氢氧钠溶液相混合,下列叙述正确的( )
A.若两者恰好中和,则一定是a=b
B.若混合液显碱性,则一定是b≥a
C.若混合液显中性,则一定是a≤b
D.若混合液显酸性,则一定是a≥b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是

A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)请写出Z-的的离子结构示意图_____________。
(2)请写出Z单质溶于X2Y中发生反应的化学方程式_____________。
(3)请写出Z单质与NaOH反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.乙烯、聚氯乙烯和苯中均含有碳碳双键
B.植物油含不饱和高级脂肪酸酯,能使![]() 的
的![]() 溶液褪色
溶液褪色
C.乙酸乙酯中混有的少量乙酸,可用饱和![]() 溶液除去
溶液除去
D.用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒![]() 为主的某石煤为原料(含有
为主的某石煤为原料(含有![]() 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备![]() ,其流程如下:
,其流程如下:
![]()
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 |
|
|
|
|
(1)焙烧:向石煤中加生石灰焙烧,将![]() 转化为
转化为![]() 的化学方程式是________________。
的化学方程式是________________。
(2)酸浸:![]() 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的![]() ,
,![]() 溶于盐酸的离子方程式是________________。
溶于盐酸的离子方程式是________________。
(3)转沉:将浸出液中的钒转化为![]() 固体,其流程如下:
固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是____________________________________。
②向![]() 溶液中加入
溶液中加入![]() 溶液,控制溶液的
溶液,控制溶液的![]() 。当
。当![]() 时,
时,![]() 的产量明显降低,原因是_______________________________________。
的产量明显降低,原因是_______________________________________。
(4)实验室以![]() 为原料还可以合成用于制备
为原料还可以合成用于制备![]() 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
![]()
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:![]() 能被
能被![]() 氧化。
氧化。
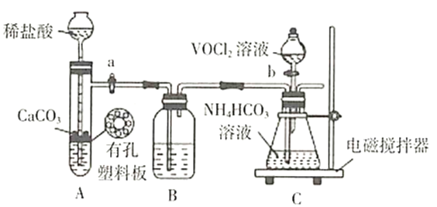
药品填装完成后的实验操作是________(填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加![]() 的
的![]() 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%![]() 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的![]() ,最后用
,最后用![]() 的
的![]() 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: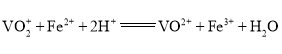 )。
)。
![]() 溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
溶液的作用是________________,粗产品中钒的质量分数为________________(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量浓度的①CH3COOH 溶液,②盐酸,c(H+)较大的是____________(填编号);CH3COOH 的电离方程式为____________。
(2)FeCl3溶液保存时需加少量____________(填“盐酸”或“硫酸”)。
(3)甲醇 CH3OH 是一种重要的化工原料,在生产中有着广泛的应用。合成 CH3OH 的一种 反应为:CO(g) + 2H2(g)![]() CH3OH (g)。一定条件下,将 1 mol CO 和 2 mol H2在 1L 容器中发生上述反应,经过 2 min 反应生成了 a mol CH3OH(反应前后体积不变)。
CH3OH (g)。一定条件下,将 1 mol CO 和 2 mol H2在 1L 容器中发生上述反应,经过 2 min 反应生成了 a mol CH3OH(反应前后体积不变)。
①此时 CO 的浓度为____________mol/L 。
②2min 内用 H2 表示该反应的速率为 v(H2) =____________mol/(L·min)。
③升高温度,反应的平衡常数 K 减小,则该反应为____________(填“吸热反应”或“放热反应”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com