
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
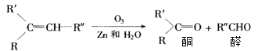
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中![]() 值增大,可以采取的措施是
值增大,可以采取的措施是
A.加少量烧碱B.降低温度C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子轨道表示式___,3d能级上的未成对的电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点_______(“高于”或“低于”)膦(PH3),原因是______。
(3)单质铜及镍都是由__键形成的晶体:元素同与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是___。
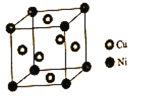
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为___。
②若合金的密度为dg/cm3,晶胞参数a=____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外化学兴趣小组欲从铝土矿中提取少量的Al2O3,查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
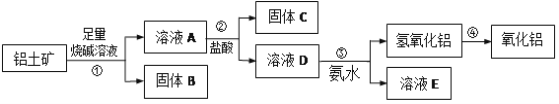
(1)固体B的主要用途为(只写一种即可)______;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应。发生反应的离子方程式是:______
(3)第③步的实验操作名称是______,请简述洗涤的操作过程______。若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与炭、Cl2在高温条件下反应,已知每消耗0.5mol炭单质,转移1mol电子,则该反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀:
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D、的化学式:C_______,D______。
(2)将含1 mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,请写出A与E反应的离子方程式:_______________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________。
(4)C常用作净水剂,用离子方程式和适当文字说明其净水原理______________________。
(5)若向含溶质0.5 mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是

A.图①表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g)+O2(g)![]() 2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矶溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(0H)2溶液体积的关系,在加入20mL溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg![]() 随n(NaOH)的变化如下图所示。下列说法不正确的是
随n(NaOH)的变化如下图所示。下列说法不正确的是

A. HX为强酸,HY为弱酸 B. b点时溶液呈中性
C. 水的电离程度:d>c D. c点时溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)+270KJ,下列说法正确的是
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270KJ
D.该反应过程的能量变化可用图来表示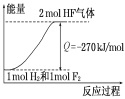
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com