
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中![]() 值增大,可以采取的措施是
值增大,可以采取的措施是
A.加少量烧碱B.降低温度C.加少量冰醋酸D.加水
【答案】D
【解析】
A.加入少量烧碱溶液,反应生成CH3COONa,c(CH3COO-)增大,则c(H+)/c(CH3COOH)=Ka/c(CH3COO-)减小,故A错误;
B.醋酸的电离是吸热反应,降低温度,抑制醋酸电离,平衡向逆反应方向移动,c(H+)减小,c(CH3COOH)增大,则c(H+)/c(CH3COOH)值减小,故B错误;
C.加入少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,增多的醋酸电离分子个数远远小于加入醋酸分子个数,则c(H+)/c(CH3COOH)值减小,故C错误;
D.加水稀释促进醋酸电离,则氢离子的物质的量增大,醋酸分子的物质的量减小,溶液体积相同,所以溶中c(H+)/c(CH3COOH)值增大,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物。下列说法错误的是( )
A.CuCl2溶液呈黄绿色,是由于存在配离子[CuCl4]2-
B.配合物[PtCl2(NH3)2]为平面结构,存在顺反异构体
C.配合物[Ti(OH)4(H2O)2]2+中Ti4+的配位数是4
D.向配合物[TiCl(H2O)5]Cl2·H2O溶液中加入足量AgNO3溶液,只有![]() 的Cl被沉淀
的Cl被沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铁表面镀铜时,将铁与电源的正极相连,铜与电源的负极相连
B. 0.01 mol Cl2通入足量水中,转移电子的数目为6.02×1021
C. 反应3C(s)+CaO(s)===CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的ΔH>0
D. 加水稀释0.1 mol·L-1CH3COOH溶液,溶液中所有离子的浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推法在化学学习中经常采用,下列类推的结论正确的是()
A.由Cl2+2KBr=2KCl+Br2,所以F2也能与KBr溶液反应置换出Br2
B.常温下,由Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C.由Cu+Cl2![]() CuCl2,所以Cu+I2
CuCl2,所以Cu+I2![]() CuI2
CuI2
D.由钠保存在煤油中,所以钾也可以保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
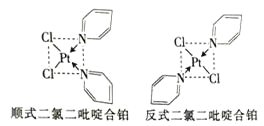
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体![]() 如图
如图![]() 。科学研究表明,顺式分子具有抗癌活性。
。科学研究表明,顺式分子具有抗癌活性。
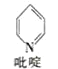
①吡啶分子是大体积平面配体,结构简式如图所示。吡啶分子中N原子的杂化方式是____,分子中的大π键可用符号![]() 表示,其中m表示参与形成大π键的原子个数,n表示参与形成大π键的电子个数。则吡啶中的大π键应表示为_____。
表示,其中m表示参与形成大π键的原子个数,n表示参与形成大π键的电子个数。则吡啶中的大π键应表示为_____。
②二氯二吡啶合铂分子中所含的C、N、Cl三种元素的第一电离能由大到小的顺序是_____。
③二氯二吡啶合铂分子中存在的微粒间作用力有_________![]() 填字母
填字母![]() 。
。
![]() 离子键
离子键 ![]() 配位键
配位键 ![]() 金属键
金属键 ![]() 非极性键
非极性键 ![]() 氢键
氢键 ![]() 极性键
极性键
④反式二氯二吡啶合铂分子是_________![]() 填“极性分子”或“非极性分子”
填“极性分子”或“非极性分子”![]() 。
。
⑤二氯二吡啶合铂分子是平面结构,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3,简述理由______________。
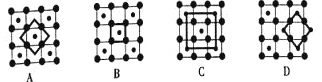
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构![]() 如图所示,小球表示Co原子,大球表示O原子
如图所示,小球表示Co原子,大球表示O原子![]() 。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是__________
。图中用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是__________![]() 填字母
填字母![]() 。
。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为d g
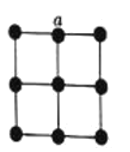
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
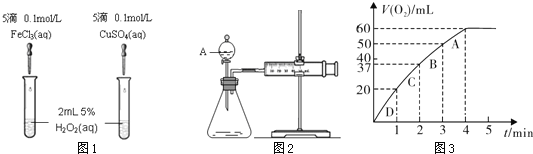
(1)定性如图1可通过观察_______,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是_______。
(2)定量如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式________________。
②实验时放出气体的总体积是________mL。
③A、B、C、D各点反应速率快慢的顺序为:___>___>___>___。
解释反应速率变化的原因___________________。
④H2O2的初始物质的量浓度是___________(请保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和一种有机物酮,如:
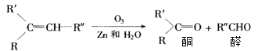
现有化学式C7H14的烯烃,与H2完全加成后的产物,核磁共振氢谱有三组峰,且峰面积之比为9:6:1,满足条件的烯烃经O3氧化后,在Zn存在下水解的产物共可能有几种(不考虑立体异构)( )
A. 2种B. 4种C. 5种D. 6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com