
分析 (1)根据所给信息为第二周期中水和HF的易燃性依次降低得出原子序数越大,越难燃烧,据此解答;
(2)依据所给化合物的毒性,磷化氢大于氨气以及四氯化碳的毒性大于四氟化碳得出,原子序数越大,氢化物的毒性越强;
(3)组成和结构相似的物质,相对分子质量越大,沸点越高.如沸点:CF4<CCl4<CBr4<CI4.又如沸点:CO2(常温下气态)<CS2(常温下液态).
解答 解:(1)根据HF的可燃性最小,可知:同周期元素气态氢化物的可燃性从左向右逐渐减弱,故答案为:CH4;NH3;H2S;HCl;
(2)由“毒性:PH3>NH3,”可知:同主族元素的化合物的毒性从上到下逐渐增大,由于第二周期中原子序数C<N<O<F,故氢化物的易燃性:CH4>NH3>H2O>HF,第三周期原子序数:Si<P<S<Cl,故易燃性SiH4>PH3>H2S>HCl,故答案为:>;>;
(3)由“新的制冷剂沸点”应介于CCl4和CF4之间,将CCl4分子中的Cl原子用F原子取代(或将CF4分子中的F原子用Cl原子取代),可得CCl3F、CCl2F2、CClF3.根据组成和结构相似的物质,沸点随相对分子质量的增大而升高,可知沸点:CF4<CClF3<CCl2F2<Cl3F<CCl4. 故答案为:CCl3F或CClF3.
点评 本题主要考查了元素周期律的应用,锻炼了同学们的审题的能力,根据题目信息结合所学知识来答题,有较大的难度.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.
物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ③⑤⑥ | C. | ①②④⑦ | D. | ②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
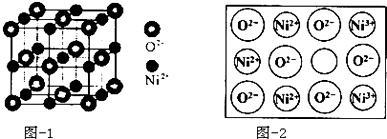
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:W>Z>Y>X | |
| B. | W氢化物的沸点比X氢化物的沸点高 | |
| C. | Y元素的周期序数等于主族序数 | |
| D. | Y、Z两元素的最高价氧化物对应的水化物能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
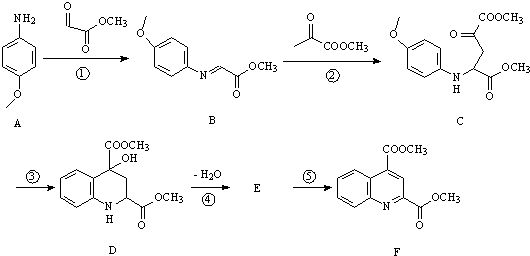

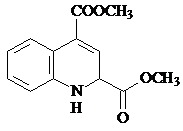 .
. 或
或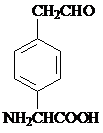 .
.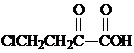 和苯、乙醇为原料,可合成
和苯、乙醇为原料,可合成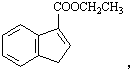 ,写出合成流程
,写出合成流程
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA | |
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) | |
| D. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com