
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【答案】C
【解析】
A.设甲容器中平衡时反应掉的二氧化碳的浓度为xmol/L,根据K=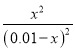 =2.25,得x=0.006,所以CO2的转化率为60%,H2的转化率也是60%,在乙容器中相当于是甲容器中增加了H2,CO2的转化率增大,故A不选;
=2.25,得x=0.006,所以CO2的转化率为60%,H2的转化率也是60%,在乙容器中相当于是甲容器中增加了H2,CO2的转化率增大,故A不选;
B.设甲容器中平衡时反应掉的氢气的浓度为xmol/L,根据K=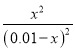 =2.25,得x=0.006,所以H2的转化率是60%,又甲和丙为等效平衡,所以甲中和丙中H2的转化率均是60%,故B不选;
=2.25,得x=0.006,所以H2的转化率是60%,又甲和丙为等效平衡,所以甲中和丙中H2的转化率均是60%,故B不选;
C.由A的分析可知,平衡时甲容器中c(CO2)是0.004mol/L,而甲和丙为等效平衡,但丙的起始浓度为甲的两倍,所以平衡时,丙中c(CO2)是0.008mol/L,故C选;
D.根据浓度越大反应速率越快可知,反应开始时,丙中的反应物浓度最大,所以反应速率最快,甲中的反应物浓度最小,所以反应速率最慢,故D不选;
综上所述,故选C。


科目:高中化学 来源: 题型:
【题目】下列各离子①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+中,不影响水的电离平衡的是( )
A.①③⑤⑦⑧B.②④⑦C.①⑥D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
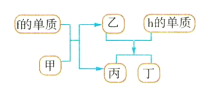
请写出h的单质与乙反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的核电荷数依次增大,它们的简单离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于其电子总数的一半。
请回答下列问题:
(1)四种元素的元素符号依次是A________B________C________D________。它们的原子半径由大到小的顺序是________________(用元素符号表示)。
(2)试写出四种元素的简单离子结构示意图A________B________C________D________。它们的离子半径由大到小的顺序是________________(用元素符号表示)
(3)A、B、C、D的最高价氧化物对应水化物的化学式分别是________________,分别比较其最高价氧化物对应水化物酸性和碱性的强弱________________。
(4)写出其中非金属元素形成的气态氢化物的化学式:________,其稳定性强弱是_________,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定等物质的量浓度的H2CO3、H2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别放入相同浓度的盐酸中 | 比较铁、铜的金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列过程的离子方程式不正确的是
A.K2Cr2O7 溶液中加入浓 NaOH 溶液后变黄:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4+![]() ==CaCO3+
==CaCO3+![]()
D.向Ca(HCO3)2 溶液中滴加少量 NaOH 溶液生成白色沉淀:Ca2++2![]() +2OH-=CaCO3↓+
+2OH-=CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛和钛的合金已被广泛应用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有![]() Ti和
Ti和![]() Ti两种原子,它们互称为________。Ti元素在元素周期表中的位置是第________周期,第________族;基态原子的电子排布式为________,按外围电子排布特征Ti元素在元素周期表分区中属于___________区元素。
Ti两种原子,它们互称为________。Ti元素在元素周期表中的位置是第________周期,第________族;基态原子的电子排布式为________,按外围电子排布特征Ti元素在元素周期表分区中属于___________区元素。
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是_____________。
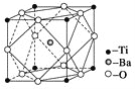
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是________,该配合物的配位体是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com