
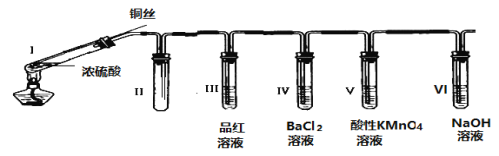
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
请回答:
(1)连接好装置后,接下来的操作步骤是________________
(2)浓硫酸与铜丝反应的化学方程式为________________
(3)装置II的作用是________________
(4)下列说法正确的是________________
A 反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色
B 试管III、V中溶液都会褪色,其褪色原理相同
C 取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4
D 试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替
(5)某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是________________
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
【答案】气密性检查 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 防止倒吸 ACD BC
CuSO4+SO2↑+2H2O 防止倒吸 ACD BC
【解析】
Ⅰ中浓硫酸和铜在加热条件下反应生成二氧化硫,II为防倒吸装置,IⅡ中品红褪色,二氧化硫与氯化钡不反应,IV中无现象,若振荡,可被空气中氧气氧化生成硫酸钡,V中二氧化硫可使高锰酸钾褪色,VI用于吸收二氧化硫,防止污染环境
(1)反应生成气体,且有气体参加反应,则连接好装置后,应检查装置的气密性;
(2)铜与浓硫酸在加热条件下生成二氧化硫、硫酸铜和水,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)装置II为安全瓶,用于防止倒吸;
(4)A.反应后,将试管Ⅰ生成硫酸铜,加入水中,溶液呈蓝色,故A正确;
B.试管III褪色与二氧化硫的漂白性有关,V中溶液褪色与二氧化硫的还原性有关,其褪色原理不同,故B错误;
C.取下试管Ⅲ并不断振荡,亚硫酸可被氧化生成硫酸,试管中出现浑浊,是因为生成了BaSO4,故C正确;
D.碳酸钠溶液呈碱性,可吸收二氧化硫,反应生成亚硫酸钠,故D正确。
故答案为:ACD;
(5)如硫酸有剩余,则溶液呈酸性,加入铁粉、NaHCO3溶液,可生成气体,稀硫酸与Ag不反应,
故答案为:BC。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】元素周期表第四周期的8、9、10列元素为X、Y、Z,它们的化合物在生产生活中有着广泛的应用。回答下列问题(涉及的化学式用元素符号表示)
(1)基态X原子的价电子排布式为______________________,Z2+核外3d能级上有___________对成对电子。
(2)Y3+的一种配离子[Y(N3) (NH3)5]2+中,Y3+的配位数是___________,lmol配离子中所含σ键的数目为___________,配位体N3-中心原子杂化类型为______________________。
(3)Y2+在水溶液中以[Y(H2O)6]2+存在。向含Y2+的溶液中加入过量氨水可生成更稳定的[Y(NH3)6]2+,其原因是____________________________________________。
(4)X离子与KCN形成的蓝色晶体中,X2+、X3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为______________________,立方体中X2+间连接起来形成的空间构型是____________________。
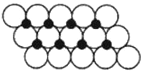
(5)一定温度下,ZO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Z2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为___________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A.检查酒驾时,CrO3被酒精氧化成Cr2 (SO4)3
B.向海水中加入明矾可以使海水淡化
C.碳海绵吸收泄露的原油时发生了化学变化
D.氧化钙可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
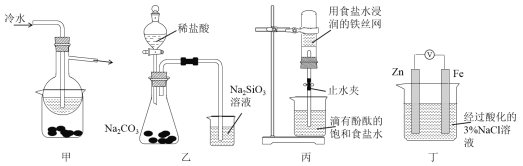
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作或实验注意事项中,主要是基于实验安全考虑的是
A. 可燃性气体的验纯 B. 滴管不能交叉使用
C. 容量瓶在使用前进行检漏 D. 实验剩余的药品不能放回原试剂瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是
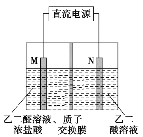
A. M极与直流电源的负极相连
B. 每得到lmol乙醛酸将有2molH+从右室迁移到左室
C. N电极上的电极反应式:HOOC-COOH-2eˉ+2H+ = HOOC-CHO+H2O
D. 每消耗0.1mol乙二醛在M电极放出2.24L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。
Ⅰ.实验室制备NaN3
(1)实验原理:
①把氨气通入熔融金属钠反应制得氨基钠(NaNH2),该反应的化学方程式为____________。
②将生成的NaNH2与N2O在210℃-220℃下反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______。
(2)实验装置(图1)、步骤如下,回答下列问题:
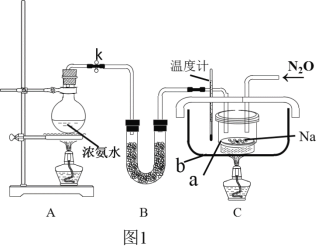
已知:i)NaN3是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
ii)NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
①组装仪器检查装置气密性后,装入药品。装置B中盛放的药品是_______________。
②实验过程应先点燃___(填“A”或“C”)处的酒精灯,理由是_______________________。
③让氨气和熔化的钠充分反应后,停止加热A并关闭止水夹k。向装置C中b容器内充入加热介质植物油并加热到210℃-220℃,然后按图通入N2O;
④装置C反应完全结束后,冷却,取出a中的混合物进行以下操作,得到NaN3固体:

操作II的目的是____________;
操作IV中选用的洗涤试剂最好的是_____。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
(3)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是____________________。
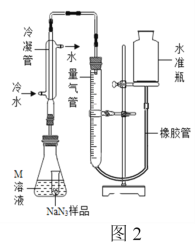
II.产品NaN3纯度测定
精确称量0.150 g NaN3样品,设计如图2所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度。
已知2 NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(4)使用冷水冷凝的目的是______。对量气管读数时,反应前后都需要进行的操作是______。
(5)常温下测得量气管读数为60.0 mL(N2的密度为1.40 g/L)计算NaN3样品的纯度为______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池总反应为Fe+2Fe3+=3Fe2+,下列与此电,池总反应不符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)3溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超导材料为具有零电阻及磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox。现欲合成0.5 mol此高温超导物,依化学计量数比例需取Y2O3、BaCO3和CuO的物质的量分别为( )
A. 0.50 mol、0.50 mol、0.50 mol B. 0.25 mol、1.0 mol、1.5 mol
C. 0.50 mol、1.0 mol、1.5 mol D. 1.0 mol、0.25 mol、0.17 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com