
【题目】如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( ) 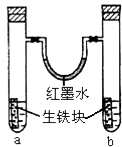
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe﹣2e﹣→Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【答案】B
【解析】解:A、生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,故A正确. B、左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,所以左边试管内气体的氧气减小,右边试管内气体的压强不大,导致U型管内红墨水左高右低,故B错误.
C、生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上铁失电子发生氧化反应Fe﹣2e﹣→Fe2+ , 故C正确.
D、左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,故D正确.
故选B.
生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀.


科目:高中化学 来源: 题型:
【题目】某氯化钾样品含少量的碳酸钾、硫酸钾和不溶于水的杂质,为了提纯氯化钾,先将样品溶于适量的水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作.下列说法正确的是( ) 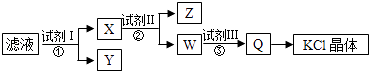
A.图示的步骤中必需要经过2次过滤操作
B.起始滤液呈中性
C.试剂Ⅱ为Na2CO3溶液
D.试剂Ⅲ为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一. A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质.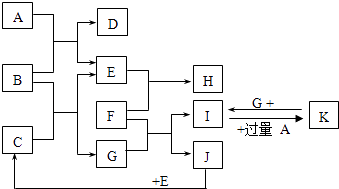
试回答下列问题:
(1)写出B的化学式: , 写出A的电子式;
(2)写出I→K的离子方程式;
(3)写出F与Fe3O4在高温下反应的化学方程式;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.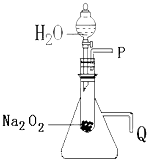
(1)由上述实验现象所推出的结论是:第一:有氧气生成;第二: . Na2O2跟水反应的化学方程式是 .
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,以证明上述结论.①用以验证第一条结论的实验操作及现象是:
②用以验证第二条结论的实验操作及现象是:
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2 , H2O2具有强氧化性和漂白性.请从另外一个角度(即不能再使用酸碱指示剂)设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
A.0.1mol﹣NH2(氨基)中含有的电子数目为1.0NA
B.常温下,1L 0.1molL﹣1 CH3COONa溶液中含有的CH3COO﹣和Na+总数为0.2NA
C.标准状况下,2.24 LH2O中含有的原子总数为3NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:

(1)实验中观察到的现象是_______________。(选填代号)
A.试管中镁片逐渐溶解 B.试管中产生无色气泡
C.烧杯外壁变冷 D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于_____________(选填“氧化还原反应”或“非氧化还原反应”)。
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”“小于”“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)C(g)+D(s)反应的平衡常数与温度的关系如下:
温度℃ | 700 | 800 | 880 | 1000 | 1200 |
平衡常数 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01molL﹣1min﹣1 , 则2min时c(A)=molL﹣1 , C的物质的量为mol;若经过一段时间后,反应达到平衡时再向容器中充入0.4molA,则再次达到平衡后A的百分含量与第一次平衡相比(填“增大”、“减小”、或“不变”)
(3)下列选项中能作为判断反应达到平衡的依据有 a.压强不随时间改变
b.v(A):v(b)=1:1
c.单位时间内消耗A和B的物质的量相等
d.C的百分含量保持不变
(4)880℃ 时,反应 C(g)+D(s)A(g)+B(g)的平衡常数的值为 .
(5)某温度时,平衡浓度符合下式:c(A).c(B)=c(C),则该此时的温度为℃.
(6)图是1000℃时容器中A的物质的量的变化曲线,请在图中补画出该反应在1200℃时A的物质的量的变化曲线图 . 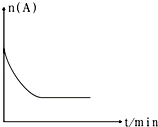
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
2NH3(g),若氮气浓度由0.1molL﹣1降到0.06molL﹣1需2s,那么由0.06molL﹣1降到0.024molL﹣1需要的反应时间为( )
A.等于1.8 s
B.等于1.2 s
C.大于1.8 s
D.小于1.8 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com