
可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是( )
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是( )
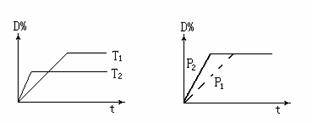
A.化学方程式系数m+n = r+q
B.使用催化剂,D的物质的量分数增加
C.温度降低,化学平衡向正反应方向移动
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
科目:高中化学 来源: 题型:
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是___________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
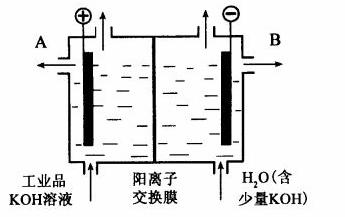
①该电解槽的阳极反应式是__________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因
_______________________________________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
A.纯盐酸、空气、硫酸、干冰 B.蒸馏水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、铁、碳酸钙 D.生石灰、漂白粉、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为 ;
(3)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下)
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是( )
①一定含有HBr,可能含有CO2 ②一定不含CO2 ③一定不含NH3、Cl2
④可能含有Cl2、CO2
A.①和③ B.只有③ C. 只有① D.②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。
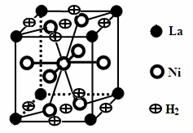
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个热化学方程式__________________________________________。
(2)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,则丁烷的燃烧热ΔH=___________。已知1 mol液态水汽化时需要吸收44 kJ的热量,则反应:C4H10(g)+ O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com