
【题目】请按要求完成下列各题:
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其反应的离子方程式为___。
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为___,反应过程分两步,其中第2步反应的化学方程式为___。
(3)写出溶液中硫酸氢钠的电离方程式___。
(4)配制某浓度的稀硫酸,用10mL量筒量取浓硫酸的体积如图Ⅰ所示,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中浓硫酸的体积是___mL。

(5)要用CuSO4·5H2O晶体配制500mL0.01mol/LCuSO4溶液,应该用托盘天平称取CuSO4·5H2O___g(读到小数点后两位)
(6)图Ⅱ所示仪器的名称是___。
【答案】2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑ 生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 NaHSO4=Na++H++SO42- 7.2 1.25 500mL容量瓶
【解析】
(1)将一小块钠投入到盛CuSO4溶液的烧杯中,钠与水反应生成氢气和氢氧化钠,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,总离子方程式为2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑;
(2)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,先生成氢氧化亚铁沉淀,氢氧化亚铁被氧气氧化成红褐色氢氧化铁沉淀,所以可以观察到:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;第二步反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)硫酸氢钠在水溶液中完全电离,方程式为NaHSO4=Na++H++SO42-;
(4)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为8,则刻度B为7,AB间每一小格为0.2mL,则量筒中液体的体积为7.2mL;
(5)配制500mL0.01mol/LCuSO4溶液,需要CuSO45H2O的物质的量为0.01mol/L×0.5L=0.005mol,质量为0.005×250g/mol=1.25g。
(6)图Ⅱ所示仪器的名称500mL容量瓶。


科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应,理由是__________。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(5)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,![]() 的名称为2,4,5-三甲基己烷
的名称为2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代产物有6种
C. 化合物![]() 是苯的同系物
是苯的同系物
D. 分子![]() 中,位于同一平面上碳原子最多有6个
中,位于同一平面上碳原子最多有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种常见的有机物,下列有关该物质的说法不正确的是( )
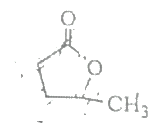
A. 分子式为C5H8O2,分子中有15个σ键和1个π键
B. 分子中的碳氧键有2种键长
C. 该物质在光照条件下与氯气反应,形成新的σ键
D. 该物质在碱性条件下加热,断裂的是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
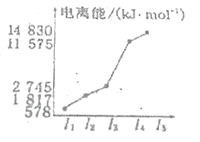
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a. b.
b.![]()
c. d.
d.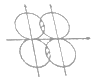
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )

A. ①②③ B. ②③④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然黄铜矿主要成分为![]() (含
(含![]() ),为测定该黄铜矿的纯度,某同学设计了如下实验:
),为测定该黄铜矿的纯度,某同学设计了如下实验:
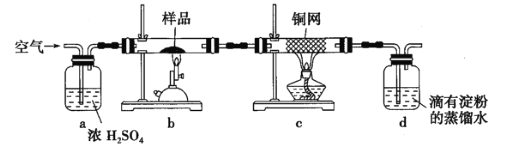
称取硏细的黄铜矿样品![]() 煅烧,生成
煅烧,生成![]() 、
、![]() 、
、![]() 和
和![]() 气体,实验后取
气体,实验后取![]() 中溶液的1/10置于锥形瓶中,用
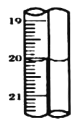
中溶液的1/10置于锥形瓶中,用![]() 标准碘溶液进行滴定,初读数为
标准碘溶液进行滴定,初读数为![]() ,末读数如图所示,完成下列填空:
,末读数如图所示,完成下列填空:
(1)实验中称量样品所需定量仪器为____________。
(2)装置![]() 的作用是____________。
的作用是____________。
(3)上述反应结束后,仍需通一段时间的空气,其目的是____________。
(4)滴定时,标准碘溶液所耗体积为______![]() 。用化学方程式表示滴定的原理:____________。
。用化学方程式表示滴定的原理:____________。
(5)计算该黄铜矿的纯度____________。
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含![]() ,
,![]() ,
,![]() ,
,![]() )可制备
)可制备![]() 。选用提供的试剂:稀盐酸、稀硫酸、
。选用提供的试剂:稀盐酸、稀硫酸、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,设计实验验证炉渣中含有
溶液,设计实验验证炉渣中含有![]() 。所选试剂为____________,证明炉渣中含有
。所选试剂为____________,证明炉渣中含有![]() 的实验方案为____________。
的实验方案为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,以MnO2为原料制得的MnCl2溶液中常合有Cu2+、Pb2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-→CuS↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com