
| A、增大 | B、减小 |
| C、不变 | D、可能增大,也可能减小 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、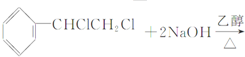  | |||
D、2CH3OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的Mg、Al共0.2 mo1 |
| B、参加反应的HC1为0.4mol |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量的稀硫酸反应能产生0.2molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于0.6mol |
| B、等于1mol |
| C、0.6mol<n(CO2)<1mol |
| D、大于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m+2、10+n |
| B、m、n |
| C、3、7 |
| D、m-2、10-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 卡片No:28 Date:2014.3.8 实验后的记录: ①Zn为阳极,Cu为阴极; ②H+向负极移动; ③电子流动方向为Zn→Cu; ④Cu极有H2产生; ⑤若有1mol电子流过导线,则产生H2为0.5mol; ⑥正极电极反应式:Zn-2e=Zn2+. |
| A、①②③ | B、③④⑤ | C、④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com