
| A、参加反应的Mg、Al共0.2 mo1 |
| B、参加反应的HC1为0.4mol |
| C、Mg、Al在反应中共失去0.4 mol电子 |
| D、若与足量的稀硫酸反应能产生0.2molH2 |
| 4.48L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
 消毒液在我们日常生活中必不可少,请结合相关知识回答下列问题.
消毒液在我们日常生活中必不可少,请结合相关知识回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol| 1 |
| 2 |
| A、CO的燃烧热为566kJ/mol |
| B、如图所示可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1024(个) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

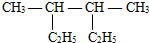
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | NaOH溶液的体积/ml | 盐酸的体积/ml | 溶液的pH |
| 1 | 20.00 | 0.00 | 8 |
| 2 | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com