
����Ŀ����14�֣�ͭ���������ϵ�dz����е���ɫ��������֪�������£�����Һ��Cu2+�ȶ���Cu+�������������·�����Ӧ��2Cu+ =Cu2++Cu�������+1��ͭ�Ļ�������������磺Cu2O��CuI��CuCl��CuH�ȡ�
��1��������Cu��OH��2����Һ�е�����������Һ���������ɲ��������ɫΪ�� ��ijͬѧʵ��ʱȴ�к�ɫ���ʳ��֣����ֺ�ɫ���ʵĻ�ѧʽΪ�� ��
��2����CuCl2��Һ����μ������KI��Һ���ܷ�����
a.2Cu2++4I- =2CuI��(��ɫ)+I2
b.2Cu2++2Cl-+2I- =2CuCl��(��ɫ)+I2��
Ϊ˳���۲쵽��ɫ�������Լ��������Լ��� ��
A��SO2 B���� C��NaOH��Һ D���Ҵ�
��3��һ�������£���CuSO4�м���NH5��Ӧ�����⻯��ͭ��CuH����
����֪NH5�����Ӿ���������ԭ�Ӷ��ﵽϡ��������ȶ��ṹ����д��NH5�ĵ���ʽ�� ��
��д��CuH�ڹ���ϡ���������������ɵ����ӷ���ʽ ��
����CuH�ܽ���������ϡ�����У� ������л�ѧ����ʽ
![]()
��4�������£���0.20 mol L-1����ͭ��Һ�м�������������Һ������dz��ɫ������ͭ����������Һ��pH = 6ʱ��c(Cu2+)=________________mol.L1��
[��֪��![]()
![]() ]
]
���𰸡���14�֣���ÿ��2������1��ש��ɫ��CuO (2) B (3) ��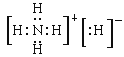
��2CuH + 2H+ ==Cu +Cu2+ + 2H2 �� ��6��16��6��3��4NO��8H2O 2.2��10-4
��������
�����������1��������Cu��OH��2����Һ�е�����������Һ�����ȷ���������ԭ��Ӧ����������ͭ�����������ˮ��������ɲ��������ɫΪש��ɫ��������ͭ���ȶ�����ת��Ϊ��ɫ������ͭ��������ֺ�ɫ���ʵĻ�ѧʽΪCuO��
��2��Ϊ˳���۲쵽��ɫ����������Ҫ�ѵ���ȡ���������Կ��Լ��������Լ�������ѡB��
��3������֪NH5�����Ӿ���������ԭ�Ӷ��ﵽϡ��������ȶ��ṹ����˵�������ӻ���������H-��笠����ֹ��ɵģ�����NH5�ĵ���ʽΪ ��
��
��Cu+�������������·�����Ӧ2Cu+��Cu2++Cu����CuH�ڹ���ϡ���������������ɵ����ӷ���ʽΪ2CuH + 2H+ ==Cu +Cu2+ + 2H2 ����
���������ǿ�����ԣ����ͭת��Ϊ����ͭ����ԭ������NO�������ˮ���������ɣ�1molCuHʧȥ2�����ӣ��������������õ�3�����ӣ�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��ƽ��ķ���ʽΪ6CuH��16HNO3��6Cu(NO3)2��3H2����4NO����8H2O.
��4����ҺpH��6�������������ӵ�Ũ��ˮ10��8mol/L�����Ը���������ͭ���ܶȻ�������֪��Һ��ͭ����Ũ����![]() ��2.2��10-4mol/L��
��2.2��10-4mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ����Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش��������⣺

�� ��������ĸ�����14��Ԫ���У���ѧ��������õ���________������Ԫ���н�������ǿ����_______�������µ���ΪҺ̬�ķǽ���Ԫ����_______�����ڹ���Ԫ�ص���_________��
��C��G��F��̬�⻯����ȶ���˳����______________________ ��
�۵���������ԭ�Ӱ뾶��С��Ԫ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�ǰ�����ڵ�Ԫ�أ����Ա���ѧ����Ԫ�����ڱ����ش��������⣺
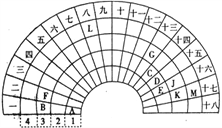
��1��E������Ԫ�ش��ڳ������ڱ���λ����___________��G�����ӽṹʾ��ͼ_____________��
��2��CE2�ĵ���ʽ��__________________��
��3��Ԫ��A��M�γɵĻ������ˮ��Һ��Ԫ��K�ĵ��ʷ�Ӧ�����ӷ���ʽΪ��__________________����Ӧ������Һ�м���CK4�ܼ���������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�Һ©�����Է����һ��Һ�������ǣ� ��
A. ���ͺ�ˮ B. �����屽 C. ��������ˮ D. �ƾ�����ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2(SO4) 3��b(NH4) 2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������������������ƣ��������Ϊԭ�ϣ���������¹���������ȡ������李�
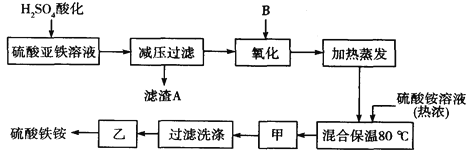
��ش��������⣺
��1���������������ʺϵ�������B�� ��
a��NaClO b��H2O2c��KMnO4d��K2Cr2O7
��Ӧ�����ӷ���ʽ ��
��2�����������У����������ʺϵ�������B����֮��ͼ�������֮ǰ����ȡ��������Fe2+�Ƿ���ȫ�����������ܷ������Ե�KMnO4��Һ����˵������ �����������ֻ�ʽ˵����
��3���������������NH4+�ķ����� ��
��4����ȡ14.00 g������Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м��뺬0.05 mol Ba (NO3)2����Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Һ��CuSO4��Һ����ij���˵���Һ�У���ʱ����۲쵽��ɫ��������˵���ò��˵���Һ�к����� ��
A������ B���Ҵ� C���Ȼ��� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾΪ4��̼ԭ�����ϵķ�ʽ��С���ʾ̼ԭ�ӣ�С����ʾ��ѧ��������̼ԭ��������Ļ�ѧ��������ԭ�ӽ�ϡ�

(1)ͼ��������������_____________(����ĸ����ͬ)��
(2)������ͼ��ʾ���л��������У�̼ԭ����̼ԭ��֮�䲻�������γɵ������������γ�_____________��_____________�����������γ�_____________���������γ�̼����
(3)����˫������_____________��������������_____________��
(4)ͼ�л�Ϊͬ���칹����ǣ�A��________��B��________��D��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����Թܷ���ʢ��25 �汥��ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ���ٵ���5 mLϡ���ᣬ������������⡣
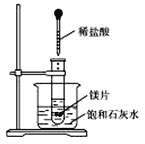
��1��ʵ���й۲쵽��������__________________��
��2���������������ԭ����__________________��
��3��д���йط�Ӧ�����ӷ���ʽ__________________
��4����ʵ����֪��MgCl2��Һ��H2��������_______________
������ڡ���С�ڡ����ڡ���þƬ���������������
��5��д���������ʵĵ���ʽ��Mg HCl NH4�� NaOH Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����Ǧ�����е�Ǧ������Na2CO3��NaHCO3��Һ����Ǧ�ࣨ��Ҫ�ɷ�PbSO4�����PbCO3��PbSO4(s) + CO32��(aq) ![]() PbCO3(s) + SO42��(aq) K = 2.2��105�� �������õ���PbCO3���պ���PbO��PbO�پ�һ��ת��ΪPb������˵����ȷ����
PbCO3(s) + SO42��(aq) K = 2.2��105�� �������õ���PbCO3���պ���PbO��PbO�پ�һ��ת��ΪPb������˵����ȷ����
A. PbSO4���ܽ��С��PbCO3
B. ����PbSO4��Na2CO3��NaHCO3��Һ��pH����
C. ���õ��������Ũ�ȵ�Na2CO3��NaHCO3��Һ�ֱ���PbSO4��Na2CO3��Һ�е�PbSO4ת���ʽϴ�
D. ���������漰һ�����ֽⷴӦ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com