
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=_______;
(2)丙溶液中存在的电离平衡为________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为________;

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=_________mL
③pH试纸测定溶液pH的操作方法为_______________________________。
【答案】PH=13 CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+ 甲=乙<丙 图2 20.00 将小片pH试纸放在点滴板上(或表面皿上)用玻璃棒蘸取少量待测液点在干燥的PH试纸上,变色后与标准比色卡对照
OH-+H+ 甲=乙<丙 图2 20.00 将小片pH试纸放在点滴板上(或表面皿上)用玻璃棒蘸取少量待测液点在干燥的PH试纸上,变色后与标准比色卡对照
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-logc(H+)计算溶液的pH值;
(2)溶液中存在电离平衡,应存在弱电解质;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(4)①乙酸为弱电解质,滴定终点时,溶液呈碱性;②NaOH和乙酸恰好反应时,消耗20mlNaOH溶液,生成弱酸强碱盐,溶液呈碱性;③pH试纸测定溶液pH不能润湿试纸。
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=10—14/0.1mol/L==10-13mol/L,故该溶液的pH=-log10-13=13,故答案为:13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水、水为弱电解质,溶质乙酸为弱电解质,存在电离平衡为CH3COOHCH3COO-+H+、H2OOH-+H+;故答案为:CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+;
OH-+H+;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:甲=乙<丙,故答案为:甲=乙<丙;
(4)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,故答案为:图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2OCH3COOH+OH-,溶液显示碱性PH>7,故答案为:20.00;
③pH试纸测定溶液pH的操作方法为将小片pH试纸放在点滴板上(或表面皿上)用玻璃棒蘸取少量待测液点在干燥的PH试纸上,变色后与标准比色卡对照,故答案为:将小片pH试纸放在点滴板上(或表面皿上)用玻璃棒蘸取少量待测液点在干燥的PH试纸上,变色后与标准比色卡对照。


科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的相对位置如下图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )

A. Z元素的氧化物对应的水化物一定是一种强酸
B. 在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
C. 三种元素原子半径的大小顺序为:X>Y>Z
D. Z的单质与 Fe 反应生成的化合物中,铁元素显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:①铝 ②Cl2 ③稀H2SO4 ④SO2 ⑤NH3 ⑥HCl ⑦CaCO3 ⑧Ba(OH)2 ⑨乙醇 ⑩NaCl溶液
属于电解质的是____,属于非电解质的是____,固态和熔化状态都不导电,溶于水后能导电且是非电解质的是____(用序号填写)。
(2)Al2(SO4)3的电离方程式为_____,Ba(OH)2的电离方程式为____。
(3)①和③反应的离子方程式为____,④和⑧反应的离子方程式为_____。
(4)二氧化氮是造成光化学烟雾的罪魁祸首。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把二氧化氮还原为氮气和水。请写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为____→_____→_____→____→E;
(2)装置 A 中反应的离子方程式是__________________;
(3)装置 E中反应的化学方程式是_____________________;
(4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。
(5)装置C的主要作用是_____________________;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
(8)配平下列离子方程式:______Fe(OH)3+ ClO![]() + OH
+ OH![]() — FeO42-+ Cl-+ H2O。
— FeO42-+ Cl-+ H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2:CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是

A. 采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B. 保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C. 反应结束,恢复至室温,调整水准管内液面与量气管液面齐平,可观察到量气管液面下降
D. 其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是

A. 原溶液中一定含有SO42-离子 B. 原溶液中一定含有NH4+离子
C. 原溶液中一定含有Cl-离子 D. 原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
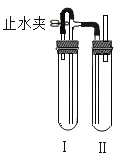
【题目】某同学用不同方法制得白色的Fe(OH)2沉淀。
(1)用未被氧化的FeSO4溶液与煮沸过的蒸馏水配制的NaOH溶液反应制备,制备过程中下列说法正确的是_______
A.用硫酸亚铁晶体配制上述FeSO4溶液时还需加入适量盐酸防止水解
B.除去蒸馏水中溶解的O2也可以采取振摇、静止的方法
C.生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液
D.FeSO4溶液上面加一层苯可以防止空气中氧气直接与溶液接触
(2)在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。在试管I 里加入稀H2SO4和铁屑,在试管II里加入NaOH溶液,打开止水夹,塞紧塞子,检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯浄时,再____(填操作步骤),这样一段时间后试管Ⅲ中制得的Fe(OH)2沉淀能较长时间保持白色,其理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如下图所示。下列有关二异丙烯基苯的说法错误的是

A. 在催化剂存在下可发生加聚反应
B. 与溴水混合后加入铁粉可发生取代反应
C. 分子中所有碳原子可能都处于同一平面
D. 其一氯代物有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com