
����Ŀ������ͪ�![]() �Ǽ���Ni2+�������Լ���
�Ǽ���Ni2+�������Լ���

��1��Ni2+��̬��������Ų�ʽΪ ������ͪ뿷�����Cԭ�ӹ���ӻ�����Ϊ ��1mol����ͪ뿷�������![]() ������ĿΪ ��
������ĿΪ ��
��2��Ni����CO�γ����ʻ���[Ni(CO)4]�����ʻ����۵㣭19.3�����е�42.1�����������л��ܼ���
��Ni(CO)4��̬ʱ���� ����(�������)��
����CO��Ϊ�ȵ������������Ϊ (�ѧʽ)��
��3��Ni2+��Mg2+��O2���γɾ���ľ����ṹ��ͼ��ʾ(Ni2+δ����)����þ���Ļ�ѧʽΪ ��
���𰸡�[Ar]3d8 sp2 sp3 15NA CN- Mg2NiO3
��������
�����������1��Ni��28��Ԫ�أ�����ԭ�Ӻ�������Ų����ɿ�֪��Ni2+�Ļ�̬��������Ų�ʽΪ[Ar]3d8������̼ԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ�Ϊsp3�ӻ������Ӽ���̼ԭ�Ӻ���3���۲���Ӷ��Ҳ����µ��Ӷԣ�Ϊsp2�ӻ�����֪����ͪ뿵ĽṹʽΪ![]() �������к���13����������2��˫��������15���Ҽ�������1mol����ͪ뿺��ЦҼ���ĿΪ15NA��
�������к���13����������2��˫��������15���Ҽ�������1mol����ͪ뿺��ЦҼ���ĿΪ15NA��
��2���ٷ��Ӿ�����۷е�ϵͣ����ʻ����۵�-19.3�棬�е�42.1�棬���Ը�����Ϊ���Ӿ��壻
���ɵڶ���������Ԫ����ɵ�����CO��Ϊ�ȵ������������ΪCN-��
��3��������λ�ڸþ��������ϣ������Ӹ���=1/4��12=3�����Ըþ�������3�������ӣ�þ���Ӵ������ϣ�þ���Ӹ���=1/2��4=2���þ����к���2��þ���ӣ����ݻ�ѧʽ��Ԫ�ػ��ϼ۴�����Ϊ�㣬�þ����к���1��Ni�����Ըþ����Ļ�ѧʽΪMg2NiO3��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��ŵ��������ѧ��ҽѧ�������й�ҩѧ���������Լ���������ѧ�����������������ձ���ѧ�Ҵ���ǣ����������ڼ����漲�������о�����ȡ�õijɾ͡������������Եط����������أ�������ű�������·�������ͼΪ�����أ����ڸ����ʵ�����˵����ȷ����

A�������ػ�ѧʽΪC15H20O5
B���ڹ��������¿��ܷ���ȡ����Ӧ
C�����������������ӳɷ�Ӧ
D��ˮ�����������ű�������õ���Ч
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5�л���ѧ������
�����ؾ��п�ͻ���Ԥ�����������ã���ϳ�·�����£�

��֪��
i��1 mol G���������Na��NaOH��NaHCO3�����ʵ����ֱ�Ϊ3 mol��2 mol��1 mol��
ii��![]()
iii�� ��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��R1��R2��R3Ϊ��������ԭ�ӣ� ��ش�
��1��B��C����Ӧ������ ��
��2��C��D��Ӧ�Ļ�ѧ����ʽ�� ��
��3��E�ĺ˴Ź����������������壬E�к��еĹ����������� ��
E��G��Ӧ�Ļ�ѧ����ʽ�� ��
��4�������й�����ȩ����������ȷ���� ��
a������ȩ����NaHCO3��Һ��Ӧ
b������ȩ����Ũ��ˮ����ȡ����Ӧ
c��1 mol����ȩ�������3 molH2�����ӳɷ�Ӧ
��5��д��һ�ַ�����������������ȩ��ͬ���칹��Ľṹ��ʽ ��
�������ϵ�һ����ȡ������2��
��1 mol������ˮ�⣬�������3 molNaOH
��6�������صķ�������2���������ṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ��������������X��ԭ�Ӱ뾶��YС��X��Wͬ���壬Z�ǵؿ��к�����ߵ�Ԫ�ء�X��Y��Z��Wԭ������������֮��Ϊ13���ʣ�
��1��X�� Y�� Z�� W�� ����Ԫ�ط��ţ�
��2��д��W������������Ӧ��ˮ����ĵ���ʽ ��д��Y�ļ��⻯��ĵ���ʽ ��
��3��Y������������Ӧ��ˮ�����Ũ��Һ���ú���ֻ�ɫ��д��������Ӧ�Ļ�ѧ����ʽ ��
��4��ʵ������ȡY���⻯��ķ���ʽ ���÷�Ӧ ����������������������������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�
������Ĥ�����������£�������Ӧ��NaCl+H2O![]() NaClO3+H2��(δ��ƽ)
NaClO3+H2��(δ��ƽ)
����NaClO3��Һ�м���KCl�������ֽⷴӦ�����½ᾧ����KClO3��
��һ�������·�Ӧ��4KClO3![]() 3KClO4+KCl�����������õ�KClO4��
3KClO4+KCl�����������õ�KClO4��
��1�����ʱ����������Ϊ2.13g NaClO3��ͬʱ�õ�H2�����Ϊ L(��״��)��
��2����NaClO3��Һ�м���KCl�ܵõ�KClO3��ԭ���� ��
��3���ù����Ƶõ�KClO4��Ʒ�к�����KCl���ʣ�Ϊ�ⶨ��Ʒ���Ƚ�������ʵ�飺
ȷ��ȡ5.689g��Ʒ����ˮ�У����250mL��Һ������ȡ��25.00mL����ƿ�У��������������ǣ�����ʹClO4-ȫ��ת��ΪCl-(��ӦΪ��3 KClO4+C6H12O6 �T 6 H2O + 6 CO2��+ 3 KCl)����������K2CrO4��Һ��ָʾ������0.20mol/L AgNO3��Һ���еζ����յ㣬����AgNO3��Һ���21.00mL���ζ��ﵽ�յ�ʱ������ש��ɫAg2CrO4������
�� ��֪�� Ksp(AgCl)��1.8��10��10��Ksp(Ag2CrO4)��1.1��10��12����c(CrO42��)��1.1��10-4mol/L�����ʱc(Cl��)�� mol/L��
�� ����KClO4��Ʒ�Ĵ���(��д��������̡�)
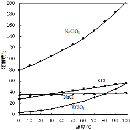
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ�
��ش��������⣺
��1��Y��Ԫ�����ڱ��е�λ��Ϊ________________��
��2������Ԫ�ص�����������Ӧ��ˮ����������ǿ����_______________��д��ѧʽ�����ǽ�����̬�⻯�ﻹԭ����ǿ����__________________��д��ѧʽ����
��3��Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������___________��д�������������ʵĻ�ѧʽ����
��4��Z2Y2�еĻ�ѧ��������_____________________��Z2Y2��ˮ��Ӧ�ų���������ӷ���ʽΪ
________ _____��
��5�� ����״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ���أ�װ��ʾ��ͼ���£�����Ӧԭ��Ϊ��
2Z + FeG2![]() Fe + 2ZG �ŵ�ʱ����صĸ�������Ϊ______������ ��Ӧ
Fe + 2ZG �ŵ�ʱ����صĸ�������Ϊ______������ ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�2NO + 2CO![]() 2CO2 + N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2 + N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
c(CO)/mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��ش���������(���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ��):
��1�� ǰ3s��ƽ����Ӧ����v(N2)��_____________��(�𰸱���2λС��)
��2�� ����4sʱCO��ת���ʦ� �� ��
��3�� ���д�ʩ�����NO��COת���CO2��N2�ķ�Ӧ���ʵ���( )
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D.��С���������
��4�� �о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ���� | T/�� | NO��ʼŨ��/mol��L-1 | CO��ʼŨ��/ mol��L-1 | �����ıȱ����/m2��g-1 |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
�� | 124 | |||
�� | 350 | 124 |
�������ϱ���������ʣ���ʵ���������ݡ�
�����ڸ���������ͼ�У������ϱ��еĢ�����ʵ�������»��������NOŨ����ʱ��仯����������ͼ������������������ʵ���š�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���༰�仯���ﱻ�㷺Ӧ���ڰ뵼�塢������������Ǧп�����̳�Ϊԭ�Ͽ��Ʊ�GeO2���乤������ͼ���¡�

��֪��GeO2�����������GeCl4��ˮ�⣬�е�86.6��
��1��������������Ҫ�ɷ���_____________���ѧʽ����ʵ������ȡ�����õ��IJ���������__________________��
��2����������ȡʱ�������ȡ����Vˮ��/V�л�����ˮ����л������ �������Ĺ�ϵ����ͼ��ʾ���������ɱ��Ƕȿ��ǣ������˵�Vˮ��/V�л�����ֵΪ ��

��3����������������������__________________________________�������㼴������Ӧ�����¶ȵķ�������Χ____________________________��
��4����������Ӧ�Ļ�ѧ����ʽ_______________________________��
��5��������������ô��������ƻ�ԭΪGe2+���õ�����Һ��ָʾ������c mol/L����ر���Һ�ζ����������VmL,�г��̳���������������ļ���ʽ________�����йط�ӦʽΪ��3Ge2++IO3-+6H+��3Ge4++I-+3H2O��IO3-+5I-+6H+��3I2+3H2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2(g)+O2(g)=2H2O(l);��H=��572kJ/mol
��2H2(g)+O2(g)=2H2O(g);��H=��484kJ/mol
��CH4(g)+2O2(g)=2H2O(l)+CO2(g);��H=��890kJ/mol
��1����֪H-H�ļ���436kJ/molO=O�ļ���496kJ/molH-O�ļ���463kJ/mol�������������ݼ����٢���һ����Ӧ����ͨ������ֱ�Ӽ���ó� ��������д����Ӧ H2O ( l ) = H2O ( g )���ʱ���H= ��
��2���������ɼ���CO2��g��+4H2( g ) =CH4( g ) +2H2O( g )���ʱ���H= ��
��3�����٢ڢ���������ʽ����һ����ȼ���ȵ��Ȼ�ѧ����ʽ �����Ӧ����ʽ����ţ���״���£�ȡ����������Ļ������11.2 L��ȫȼ�պ�ָ������£���ų�������Ϊ263.8kJ�������������м������������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com