
| 0.11-0.2X |
| 3 |
| 0.11-0.2X |
| 3 |
| 0.11-0.2X |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、熔点:Al2O3>Al |
| B、热稳定性NaHCO3>Na2CO3 |
| C、酸性:H2CO3>H2SiO3 |
| D、氧化性:Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
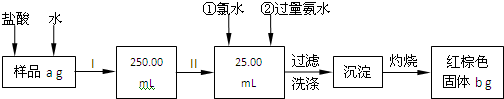
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗铜接电源负极 |
| B、精铜作阴极 |
| C、杂质都将以单质形式沉积到池底 |
| D、精铜片增重2.56g,电路中通过电子为0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com