
【题目】胶体金即金溶胶,其具有光吸收性、呈色性和胶体性等特点。免疫胶体金技术作为胶体金标记物, 可实现对抗原抗体的测定。

用白磷还原法可制得一种金的分散系,该分散系在临床诊断及药物检测等方面有着广泛的应用。
其操作步骤如下:
a.取20%白磷(①)的乙醚溶液0.5 mL,加蒸馏水(②)60 mL。
b.先滴加1%氯化金水溶液(③)0.75 mL,再滴加0.1 mol·L-1的K2CO3(④)0.6 mL,振荡变成棕红色。
c.加热煮沸至溶液变成透明红色。
d.分离提纯,除去无机溶质。
所得分散系中,金颗粒直径在5~12 nm之间。
请回答下列问题:
(1)上述物质①②③④中属于单质的是________(填序号,下同),属于化合物的是________,属于盐的是________。
(2)该分散系属于________,其分散质是_______________。
(3)所得红色溶液________(填“能”或“不能”)继续加热。
【答案】① ②④ ④ 胶体 金颗粒 不能
【解析】
(1)上述物质①②③④中,依据组成物质,筛选出纯净物;在纯净物中,含一种元素的物质是单质,含两种或两种以上元素的物质为化合物;由金属离子和酸根离子构成的化合物为盐。
(2)该分散系中,金颗粒直径在5~12 nm之间,介于1~100nm之间。
(3)分析所得红色溶液的性质,确定能否继续加热。
(1)上述物质中,①为白磷,由P元素组成,为单质;②为蒸馏水,由H、O两种元素组成的纯净物,属于化合物;③为氯化金水溶液,由氯化金和水两种物质组成,属于混合物;④为K2CO3,属于纯净物,也属于化合物。从而得出结论:属于单质的是①,属于化合物的是②④,属于盐的是④。答案为:①;②④;④;
(2)由金颗粒直径介于1~100nm之间,确定该分散系属于胶体,其分散质是金颗粒。答案为:胶体;金颗粒;
(3)分析所得红色溶液属于胶体,加热会发生凝聚,所以不能继续加热。答案为:不能。


科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
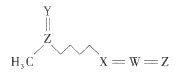
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
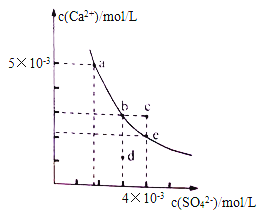
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各性质中符合图示关系的是
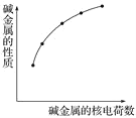
①化合价 ②ROH的碱性 ③密度 ④最外层电子数 ⑤核外电子层数 ⑥单质失e-能力
A.②④⑤⑥B.②⑤⑥C.②③⑤⑥D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示:
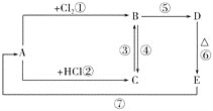
根据如图所示变化,按要求回答下列问题:
(1)写出A、E的化学式:A__,E__;
(2)写出其中几步反应的化学方程式:
C→B:___;
B→D:___;
E→A:___。
(3)C中加入NaOH溶液,看到的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制VmL 2.0mol·L-1的氢氧化钠溶液,需要氢氧化钠固体质量______ g。 下列操作,会使所配的溶液浓度如何变化。
(1)称取氢氧化钠固体时将固体放在天平托盘的纸片上:______ ;
(2)称量时左码右物,且使用了游码:_______;
(3)容量瓶用蒸馏水洗净,没有烘干:________;
(4)没有等到溶液冷却到室温就将溶液注入容量瓶中:______;
(5)转移溶液时有溶液撒出:_____,
(6)没有用蒸馏水洗烧杯和玻璃棒:____,
(7)定容时仰视液面:_____,
(8)定容时俯视液面:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
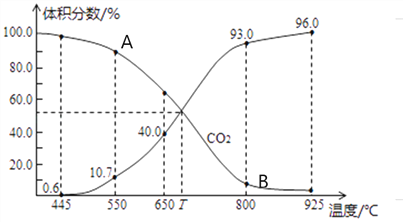
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
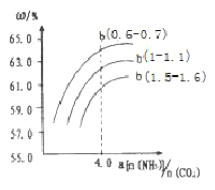
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,流程如下:
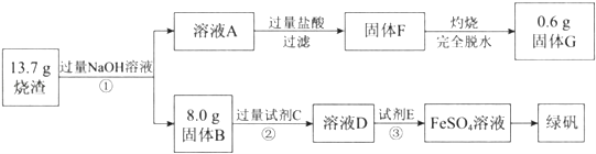
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2-、SiO32-和______。
(2)试剂C是______。
(3)③中反应的离子方程式是_______、_______。
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com