
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,流程如下:
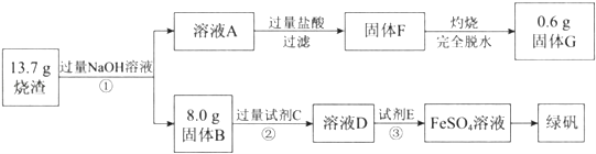
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2-、SiO32-和______。
(2)试剂C是______。
(3)③中反应的离子方程式是_______、_______。
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是______。
【答案】OH- 稀硫酸 Fe+2Fe3+=3Fe2+ Fe+2H+=Fe2++H2↑ 5:5:1
【解析】
烧渣主要成分为Fe2O3、Al2O3和SiO2,与过量NaOH溶液混合,Al2O3和SiO2反应产生NaAlO2、Na2SiO3进入溶液A中,Fe2O3不能反应进入滤渣,然后过滤得到的固体B为Fe2O3为8.0g,溶液A中含有Na+、AlO2-、SiO32-和OH-,加入过量盐酸,AlO2-转化为Al3+,SiO32-反应形成H2SiO3沉淀,发生反应的离子反应方程式为OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,然后过滤得到的固体F为H2SiO3沉淀,灼烧H2SiO3脱水分解得SiO2为0.6g;固体B为Fe2O3,向其中加过量试剂C溶解,因为要制备FeSO47H2O,所以试剂C为稀硫酸,发生反应Fe2O3+6H+=2Fe3++3H2O,所得溶液D为硫酸铁和过量稀硫酸的混合溶液,再加试剂E将三价铁还原成二价铁,则试剂E为Fe单质,最后将硫酸亚铁溶液进行蒸发浓缩、冷却结晶、过滤得到绿矾,据此分析。
(1)通过以上分析知,溶液A中含有的阴离子主要有AlO2-、SiO32-和OH-;
(2)固体B为Fe2O3,向其中加入H2SO4反应产生Fe2(SO4)3,再向该溶液中加入Fe粉,还原得到FeSO4溶液,因此试剂C是稀硫酸;
(3)③是Fe单质与Fe2(SO4)3反应产生FeSO4溶液,及与过量的H2SO4反应产生FeSO4和H2,其中反应的离子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(4)通过以上分析知Fe2O3为8.0g,,固体G是SiO2,由于在反应过程中Si元素没有损失,所以根据Si元素守恒,可知原混合物中含有SiO2为0.6g,则原混合物中Al2O3质量为m(Al2O3)=13.7g-8.0g-0.6g=5.1g,则烧渣中Fe2O3、Al2O3和SiO2的物质的量之比n(Fe2O3):n(Al2O3):n(SiO2)=![]() :
:![]() :
:![]() =0.05:0.05:0.01=5:5:1。
=0.05:0.05:0.01=5:5:1。


科目:高中化学 来源: 题型:
【题目】将2mol X和2mol Y充入2L密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
A. a的值为2
B. 平衡时X的浓度为0.8mol·L-1
C. 平衡时Y的转化率60%
D. 0~2min内Y的反应速率为0.6mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体金即金溶胶,其具有光吸收性、呈色性和胶体性等特点。免疫胶体金技术作为胶体金标记物, 可实现对抗原抗体的测定。

用白磷还原法可制得一种金的分散系,该分散系在临床诊断及药物检测等方面有着广泛的应用。
其操作步骤如下:
a.取20%白磷(①)的乙醚溶液0.5 mL,加蒸馏水(②)60 mL。
b.先滴加1%氯化金水溶液(③)0.75 mL,再滴加0.1 mol·L-1的K2CO3(④)0.6 mL,振荡变成棕红色。
c.加热煮沸至溶液变成透明红色。
d.分离提纯,除去无机溶质。
所得分散系中,金颗粒直径在5~12 nm之间。
请回答下列问题:
(1)上述物质①②③④中属于单质的是________(填序号,下同),属于化合物的是________,属于盐的是________。
(2)该分散系属于________,其分散质是_______________。
(3)所得红色溶液________(填“能”或“不能”)继续加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示,请回答:
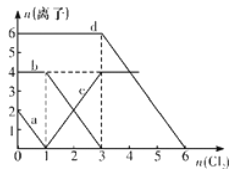
(1)a线分别代表溶液中____________的变化情况;
(2)c线分别代表溶液中____________的变化情况;
(3)原溶液中Br-与Fe2+的物质的量之比为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中进行反应:N2+3H2![]() 2NH3。该反应达到平衡的标志是
2NH3。该反应达到平衡的标志是
A.3v(H2)正=2v(NH3)逆B.单位时间生成m mol N2的同时生成3m mol H2
C.混合气体的密度不再随时间变化D.容器内的总压强不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,22gCO2含有的氧原子数为NA
B.标准状况下,2.24 L CCl4含有的分子数为0.1NA
C.常温常压下,0.1molL-1的MgCl2溶液中含Cl-数为0.2NA
D.常温常压下,5.6g铁与足量Cl2完全反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,在容积可变的密闭容器中,反应2NO2(g) N2O4(g)达到平衡后,再向容器中通入一定量的NO2,又达到平衡时,N2O4的体积分数( )
A.不变B.增大C.减小D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏伽德罗常数的值。已知常温下 1L0.1molL-1NaHSO3溶液的pH=4,该溶液中存在如下平衡:①HSO3-![]() H++SO32- ② HSO3- + H2O
H++SO32- ② HSO3- + H2O![]() H2SO3+ OH-。下列说法正确的是
H2SO3+ OH-。下列说法正确的是
A.将该溶液加热蒸干、灼烧可得NaHSO3固体
B.加水稀释该溶液,平衡①正向移动,溶液中c(H+ )增大
C.该溶液中c(OH-)+ c(SO32-)=c(H+) +c(H2SO3)
D.该溶液中阴阳离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.24L苯中含有碳碳双键数为0.3NA
B. 6.4gS2、S4和S8的混合物中所含硫原子数为0.2NA
C. 1L0.1mol·L-1的氢碘酸中含碘化氢分子数为0.1NA
D. 60g乙酸与足量乙醇发生酯化反应时断裂的C-O键数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com