
����Ŀ�����ͼ�ش����⣺
��1��ѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ���������ͼ���������ô������������Ƴ�Ũ��Ϊ0.50molL��1��ϡ����100mL�������貣���������ձ�����Ͳ������������ͷ�ι����________��
����ȡŨ��������Ϊ________ mL��
��2��д������װ�������������ƣ���________����________��
��3��������װ�����������ᣨ�е�118�����������������е�77.1�����Ļ�����ȱ�ٵ�������________��������������������е�ʵ�����������Ϊ________��
��4��ʵ���ҳ���װ���������ˮ�еĵ⣬ ���иò���ʱ�����ڵ�ˮ�м�һ�Լ�����ѡ���Լ�ʱ��������������Ϊ��Щ�����DZ���ģ�________������ţ����ٳ�����ΪҺ̬ ��I2�������ܽ�̶ȴ� ����ˮ�������� ���ܶ�Ҫ��ˮ��
���𰸡�100mL����ƿ 2.7 ������ ��Һ©�� �¶ȼ� ���� �٢ڢ�
��������
������Ҫ���黯ѧʵ���еij�������������;��
��1�������貣���������ձ�����Ͳ������������ͷ�ι����100mL����ƿ��
��Ũ��������ʵ���Ũ��Ϊc= =
=![]() =18.4mol/L����ȡŨ��������Ϊ0.50mol/L��100mL/18.4mol/L=2mL��
=18.4mol/L����ȡŨ��������Ϊ0.50mol/L��100mL/18.4mol/L=2mL��
��2������װ�������������ƣ������������۷�Һ©����
��3��������װ�����������ᣨ�е�118�����������������е�77.1�����Ļ�����ȱ�ٵ��������¶ȼƣ�������������������е�ʵ�����������Ϊ������
��4�����ڵ�ˮ�м�����ȡ������ѡ����ȡ��ʱ������������Ǣ٢ڢۡ�


 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. �ڱ�״���£�11.2 L NO ��11.2 LO2��Ϻ�����ԭ����ΪNA
B. 110 g Na2S2�к��е�������Ϊ3NA
C. 0.1mol��L-1Na2CO3��Һ1L������������ĿС��0.1NA
D. 1mol Cl2����������ˮ�У���Ӧʱ���ѵ�Cl-Cl ����ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к������������е������֣�K����Cl����NH��Mg2����CO![]() ��Ba2����SO
��Ba2����SO![]() ����ȡ3�ݸ���Һ��100 mL�ֱ��������ʵ�飺
����ȡ3�ݸ���Һ��100 mL�ֱ��������ʵ�飺
ʵ����� | ʵ������ | ʵ���� |
�� | ��AgNO3��Һ | �а�ɫ�������� |
�� | ������NaOH��Һ������ | �ռ������壬�ڱ�״�������Ϊ2.24 L |
�� | ������BaCl2��Һ�������ó�������ϴ�ӡ������������������м�����ϡ���ᣬȻ�������� | ��һ�γ�������Ϊ12.54 g���ڶ��γ�������Ϊ4.66g |
�Իش��������⣺
��1������ʵ������Cl���Ƿ���ڵ��ж���_______________(����һ����������һ������������������ȷ����)������ʵ���������жϻ������һ�������ڵ�������___________��
��2����ȷ����Һ��һ�����ڵ������Ӽ������ʵ���Ũ��(�ɲ�����)��
�����ӷ��� | ���ʵ���Ũ��(mol/L) |
__________ | |
��3����ȷ��K���Ƿ���� __________ �����������������������жϵ�����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����( )
A.���ۻ������п��ܺ����Ӽ�
B.���ӻ������п��ܺ����ۼ�
C.�ǽ���ԭ�Ӽ䲻�����γ����Ӽ�
D.�Ǽ��Լ�ֻ������˫ԭ�ӵ��ʷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�����ǰ�ȫ��������ɫ�������ͱ��ʼ���ʹ���в������°��P������Ⱦ�ij��ѧ��ȤС��ͨ����ͼ�������ա��ͷŽ����о�����ش��������⣺
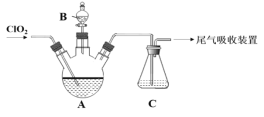
(1)��KClO3��Na2SO3��H2SO4�ữʱ��ȡClO2���÷�Ӧ�����ӷ���ʽΪ______��
(2)��ͼA��ʢ����Na2CO3-H2O2�����Һ��������ClO2�������ȶ�������֪ClO2���ȶ�����������NaClO2����C�е���KI-H2SO4��Һ������_____(������������������) ˵��������A��ClO2����ȫ���ա�
(3)��֪ClO2�����������ǵ����ʵ���Cl2��2.5������ClO2�ڽ������Һ�е�CN��������CO2��N2�ķ�Ӧ�У��������ͻ�ԭ�������ʵ���֮��Ϊ______��
(4)��B��A�еμ�ϡ���ἴ���ͷų�ClO2����ʱC��������_____����֪ClO2�ܱ������ȶ��������գ�����ClO2���ڹ��߱��ʣ�ͼ������Ч���Ϻõ��ȶ�����___(�� ������������)��ԭ����______��

(5)ClO2�ġ���Ч�ȡ���ͨ���궨��Ӧ����Һ�еIJ��ȣ�c(Cl-)�����ⶨ���ڷ�����ѧ����K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ�е�Cl-��������ש��ɫ����ʱ����ָʾ��ζ��յ㡣����֤��Һ��c(Cl-)��Ϊ1.0��10-5 mol/L�����ʱ��Һ��c(CrO42-)Ӧ������______mol/L����Ksp(AgCl)=2.0��10��10��Ksp(Ag2CrO4)=2.0��10-12�ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ȡ�����������в����Ĺ�����������Ҫ�ɷ�ΪFe2O3��Al2O3��CaO��TiO2��SiO2�ȣ�����ǿ���Է������ӳ����л����ѵĹ����������£�
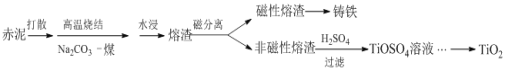
��ش��������⣺
(1)���������϶���нϴ�ıȱ����������Ϊ����SO2�����ռ����о������ù�������Ҫ�����˻�ѧ�кͷ�Ӧ�������______��
(2)�����һ����ˮ��ɢ��Ŀ����______��
(3)��֪�����ս�ʱ��TiO2�����ķ�Ӧ��Na2CO3+TiO2 ![]() Na2TiO3+CO2������Na2TiO3������ˮ����Al2O3���ս��з����ķ�Ӧ��______��ˮ��Һ�����Ҫ������______��
Na2TiO3+CO2������Na2TiO3������ˮ����Al2O3���ս��з����ķ�Ӧ��______��ˮ��Һ�����Ҫ������______��
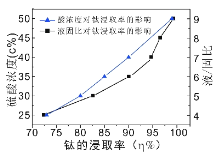
(4)���ʱ����ʹ�ѵĽ�����(��%)�ﵽ90%���������ͼ��ҵ��Ӧ��ȡ�����������ǣ���Ũ�Ⱥ�Һ�̱ȵ�ȡֵ�ֱ�ԼΪ______��______��ͬʱ�����¶ȹ��߿�����ɵĻ�����Ⱦ��__________��
(5)TiO2��һ�������¿�ת��ΪTiCl4����þ����ᴿ������TiCl4ˮ��������������Ƶ�TiO2��xH2O���ײ��ϣ���ˮ����̵Ļ�ѧ����ʽ��______��
(6)�����к���(��TiO2������������ʾ)һ��Ϊ4% ~12%�������������������ѵ��ܻ�����Ϊ75%����1t������TiO2���������Ϊ______kg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaCl��Na2SO4��NaNO3�Ļ���ѡ���ʵ����Լ���ȥ���ʣ��Ӷ��õ�������NaNO3���壬��Ӧ��ʵ��������ͼ��ʾ��

��ش��������⣺
��1��д��ʵ���������������ʵĻ�ѧʽ���Լ�X___������A____��
��2������ʵ���������٢ڢ�����Ҫ���е�ʵ�������___����������ƣ���
��3������ʵ�������м������Na2CO3��Һ��Ŀ����______________________________��
��4������ʵ�鷽���õ�����Һ3�п϶�����______���ѧʽ�����ʡ�Ϊ�˽��������⣬��������Һ3�м���������___���ѧʽ����֮����Ҫ���NaNO3���壬����е�ʵ�������____����������ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 60gSiO2��12g���ʯ�и�����4NA��Si��O����4NA��C��C��
B. H2O(g)ͨ������Na2O2(s)��ַ�Ӧ����������bgʱ����Ӧ��ת�Ƶĵ�����ΪbNA/2
C. 1L0.2mo1/ LNaHCO3��Һ�к�HCO3����CO32����������֮��Ϊ0.2NA
D. ������Mg��ϡH2SO4��ȫ��Ӧ������2.24LH2ʱ��ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������Cl2��ȣ�ClO2�������и�������ɱ�����������Ҳ��������������DZ��Σ�����л��ȴ���Ʊ�ClO2���������ַ�����
����һ��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O
��������2NaClO3+H2O2+H2SO4=2ClO2��+O2��+Na2SO4+2H2O
��1������һ�����ӷ���ʽΪ______________________________��
��2���������б�������������_______������Ӧ����0.1 mol����ת�ƣ��������ClO2�����ڱ�״���µ����Ϊ_________L��
��3����˫���ŷ��������һ�з���ʽ����ת�Ƶķ������Ŀ_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com