
【题目】某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是
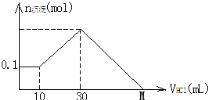
A. 70mL B. 130mL C. 120mL D. 100mL
【答案】B
【解析】
先分段分析图象,向所得浊液中,逐滴加入5mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0~10mL,随盐酸的体积增加,生成沉淀的质量不变,则盐酸和氢氧化钠中和,说明该过程产生的沉淀是Mg(OH)2,n[Mg(OH)2]=0.1mol,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生的反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10mL处,加入10mL盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10mL~30mL,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
④30mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:30mL-10mL=20mL,沉淀质量达到最大,溶液为NaCl溶液;
⑤30mL~M点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥M点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液,结合方程式、原子守恒解答。
30mL时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mLHCl,溶液中Na+来源于原混合物中的NaOH。
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
0.1mol 0.02L×5mol/L
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.1mol
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]=0.1mol,
由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.1mol×2+0.1mol×3+0.03L×5mol/L=0.65mol。
M点溶液为MgCl2、AlCl3和NaCl混合液,M点所加盐酸相当于用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.65mol;M点所表示盐酸的体积为:V=0.65mol÷5mol/L=0.13L=130mL。答案选B。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种等体积等物质的量浓度的NaOH溶液。若将甲蒸发一半水,在乙中通入少量CO2,丙不变,然后用等浓度的H2SO4溶液滴定,用甲基橙作指示剂。完全反应后,所需溶液体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>丙>甲 D.甲=乙=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质比较不正确的( )
A.热稳定性:HCl>HBr
B.沸点:H2O>H2S
C.碱性:Ca(OH)2>Mg(OH)2
D.酸性:H3PO4>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有SO![]()
C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D. 向某溶液中加入氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,说明原溶液中有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质的有关试剂正确的是
A.苯(硝基苯):蒸馏水B.苯(Br2):NaOH溶液
C.乙酸(乙酸乙酯):氢氧化钠溶液D.乙烷(乙烯):酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
A.2.8g B.5.6g C. 8.4g D.11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)现有A、B两种有机物的液体混合物,如果A、B互溶,且互相不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。分离A、B的混合物的常用方法是:________,需要的玻璃仪器除酒精灯、温度计外有_______、________、________、________。
(II)某课外小组需要配制95mL浓度为1 mol/L的NaCl溶液
(1)需要称取NaCl固体的质量为________g。
(2)在配制1 mol/L的NaCl溶液过程中,下列情况对氯化钠溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①未经冷却趁热将溶液注入容量瓶中________;
②定容后有少量NaCl溶液洒出________;
③定容时仰视观察液面________。
(3)若预将100 mL 12mol/L的盐酸稀释为6mol/L的盐酸,需要加入水的体积为________mL。(已知:12mol/L的盐酸密度为1.19g/mL,6mol/L的盐酸密度为1.1g/mL,水的密度为1.0g/mL)。
(III)过氧化钠可用于呼吸面具中作为氧气的来源,在此过程中主要发生的化学反应方程式为_______________________;当氧气生成22.4L(标准状况下)时,转移电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:

(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL2mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL1mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O![]() 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.lmol/L的HA溶液中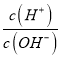 =1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是_______ 。
(2)HA的电离方程式是________。其中由水电离出的c(H+)=____mol/L。
(3)在加水稀释HA的过程中,随着水量的增加而减小的是____ (填字母)。
A.  B.
B.  C. c(H+)与c(OH-)的乘积 D.c(OH-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈________性,请用离子方程式解释其原因______________________。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/LNaHSO4,使溶液的pH为11。(混合溶液体积变化忽略不计),应加NaHSO4________mL。 (保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com