
【题目】草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:

(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL2mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL1mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O![]() 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
【答案】 促进溶解 防止溶液暴沸 取少许最后一次洗涤过滤液,向其中加入BaCl2溶液(用pH试纸检验),若无白色沉淀产生(pH等于7),说明已洗涤干净 > w(C2O42-) =![]() ×100%=43.45%
×100%=43.45%
【解析】(1)“溶解”时加热的目的是加快反应速率,促进溶解;由于反应是加热煮沸,所以“不断搅拌”除可使反应物充分接触外,另一目的是防止溶液暴沸。(2)沉淀表面含有硫酸根离子,所以 “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是取少许最后一次洗涤过滤液,向其中加入BaCl2溶液,若无白色沉淀产生,说明已洗涤干净。(3)(I)根据方程式可知n(C2O42-)=![]() ×n(KMnO4)=
×n(KMnO4)=![]() ×[0.02000 mol·L-1×(23.80-8.00) mL×10-3L·mL-1]=7.900 ×10-4 mol,n(Fe2+)=5n(KMnO4)=5×0.02000 mol·L-1×8.00) mL×10-3L·mL-1=8.000 ×10-4 mol,所以测得的产品中n(Fe2+)∶n(C2O42-)>1∶1;(II)根据以上分析可知w(C2O42-)=
×[0.02000 mol·L-1×(23.80-8.00) mL×10-3L·mL-1]=7.900 ×10-4 mol,n(Fe2+)=5n(KMnO4)=5×0.02000 mol·L-1×8.00) mL×10-3L·mL-1=8.000 ×10-4 mol,所以测得的产品中n(Fe2+)∶n(C2O42-)>1∶1;(II)根据以上分析可知w(C2O42-)=![]() ×100%=43.45%。
×100%=43.45%。


科目:高中化学 来源: 题型:
【题目】有一类组成最简单的有机硅化合物叫硅烷,它的分子结构与烷烃相似,下列有关说法错误的是
A.相同条件下,硅甲烷的密度小于甲烷
B.硅甲烷燃烧生成二氧化硅和水
C.硅烷的分子通式可表示为SinH2n+2
D.硅甲烷与硅乙烷的相对分了质量相差30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,右图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是
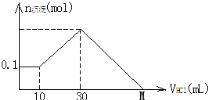
A. 70mL B. 130mL C. 120mL D. 100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子物质的量浓度为( )
A. 2(2b-a)/V mol·L-1 B. (2b-a)/V mol·L-1 C. 2(b-a)/V mol·L-1 D. (b-a)/V mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法表示下列反应的电子转移情况并将其改写成离子方程式: 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,______________,离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为酸性介质中,金属铜与氢叠氮酸(HN3) 构成的原电池,总反应方程式为: 2Cu+2Cl-+HN3+3H+=2CuCl(s)+N2↑+NH4+。下列叙述错误的是( )
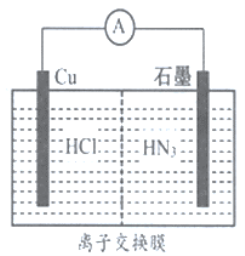
A. 离子交换膜为阳离子交换膜
B. 若将盐酸换成NaCl,电池的运行效率将会下降
C. 负极的电极反应式为:Cu-e-=Cu+
D. 当外电路中流过0.1mol电子时,交换膜左侧离子减少0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,以任意比例混合的氧气和二氧化碳混合物22.4 L,所含的分子数为NA
B. 标准状况下,1 L汽油(分子式为C8H18)完全燃烧后,所生成气体产物的分子数为8NA/22.4
C. 标准状况下,1 L SO3所含分子数为NA/22.4
D. 标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钡有剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂是( )
A.AgNO3
B.CuSO4
C.MgSO4
D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com