
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
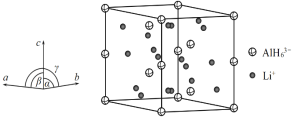
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
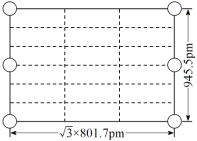
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
【答案】B V形 sp3 ![]() 10.0(9.4~10.7之间任意一个数均可) H3N-BH3+2H2O=NH4BO2+3H2 18
10.0(9.4~10.7之间任意一个数均可) H3N-BH3+2H2O=NH4BO2+3H2 18 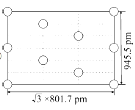 或
或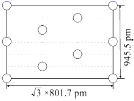
![]()
【解析】
(1)复合氢化物中氢元素的质量分数即为单位质量复合氢化物的储氢能力,Mg(NH2)2中氢的质量分数为![]() ,NaNH2中H%为
,NaNH2中H%为![]() ,H3N-BH3中H%为
,H3N-BH3中H%为![]() 、NaAlH4中H%为
、NaAlH4中H%为![]() 、⑤Li3AlH6中H%为
、⑤Li3AlH6中H%为![]() ,所以储氢能力最低的是B;
,所以储氢能力最低的是B;
(2) NH![]() 的价层电子数为
的价层电子数为![]() ,根据VSEPR理论,NH
,根据VSEPR理论,NH![]() 的理论构型为正四面体,因含两对孤对电子,所以NH2-的空间构型为V形,因价层电子对数为4,所以中心原子N的杂化方式为sp3杂化;
的理论构型为正四面体,因含两对孤对电子,所以NH2-的空间构型为V形,因价层电子对数为4,所以中心原子N的杂化方式为sp3杂化;
(3)①硼是第5号元素,在元素周期表中位于第二周期第ⅢA族、p区,其基态原子核外电子排布式为1s22s22p1,价电子排布式为2s22p1,价电子轨道表达式为![]() ;
;
②表中金属元素电负性最大的为9.3,非金属元素电负性最小的为10.8,可以判断电负性小于10.0(9.4~10.7之间任意一个数均可)的元素为金属元素;
③据表可知H的电负性大于B,所以H3N-BH3中氮原子上的氢原子带正电荷,硼原子上的氢原子带负电荷,所以H3N-BH3与水反应时,-BH3中的氢原子与水发生归中反应生成氢气,-BH3转化为B(OH)![]() (变可简写为BO
(变可简写为BO![]() ),所以反应的化学方程式为:H3N-BH3+2H2O=NH4BO2+3H2;
),所以反应的化学方程式为:H3N-BH3+2H2O=NH4BO2+3H2;
(4) ①根据AlH![]() 的分数坐标可以判断其在晶胞中的位置:8个在顶点、4个在侧棱棱心、4个在晶胞体内,由分摊法可得一个晶胞中含有6个AlH
的分数坐标可以判断其在晶胞中的位置:8个在顶点、4个在侧棱棱心、4个在晶胞体内,由分摊法可得一个晶胞中含有6个AlH![]() ,根据晶体的化学式可知晶胞中Li+与AlH
,根据晶体的化学式可知晶胞中Li+与AlH![]() 的个数比为3:1,所以一个晶胞中所含有Li+的个数为18;
的个数比为3:1,所以一个晶胞中所含有Li+的个数为18;
②由截面的边长(![]() ×801.7pm和945.5pm)可知这是过晶胞底面和顶面对角线的截面,题目表明了这个截面中一共含有10个AlH
×801.7pm和945.5pm)可知这是过晶胞底面和顶面对角线的截面,题目表明了这个截面中一共含有10个AlH![]() ,又画出4个位于顶点、2个位于棱心的AlH
,又画出4个位于顶点、2个位于棱心的AlH![]() ,所以需要画出的是4个位于晶.胞体内的AlH
,所以需要画出的是4个位于晶.胞体内的AlH![]() ,结合AlH
,结合AlH![]() 的分数坐标,即可将缺失的AlH
的分数坐标,即可将缺失的AlH![]() 补充完整,得到下图:
补充完整,得到下图: 或
或
③一个晶胞中含有6个Li3AlH6,则晶胞的质量m=![]() g,晶胞底面为菱形,根据几何知识可知晶胞的体积V=801.72×945.5×sin60°pm3,所以该晶体的密度为
g,晶胞底面为菱形,根据几何知识可知晶胞的体积V=801.72×945.5×sin60°pm3,所以该晶体的密度为![]() 。
。


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y的摩尔质量相同,Y为淡黄色固体,N常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )

A. 相对分子质量M>N,沸点M>N
B. 原子半径:D>B>C>A
C. Z 为 NaOH
D. M中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与图所示一致的是( )
A.图 用于测定NaOH溶液的浓度
用于测定NaOH溶液的浓度
B.图 表示25
表示25![]() 时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
C.图 记录滴定终点读数为12.00 mL
记录滴定终点读数为12.00 mL
D.电导率是衡量电解质溶液导电能力大小的物理量,图 表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O反应时通常加入过量的Ca(OH)2,其目的是 。
CaO2·8H2O反应时通常加入过量的Ca(OH)2,其目的是 。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,等MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
O2![]() MnO(OH)2
MnO(OH)2 ![]() I2
I2 ![]() S4O62
S4O62
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式 ;
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧为 mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
A.单位时间内生成n mol ![]() ,同时生成n mol AB
,同时生成n mol AB
B.体系内的总压不随时间变化
C.单位时间内生成2n mol AB的同时生成![]()
D.单位时间内生成![]() 的同时,生成
的同时,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种黄绿色气体,X、Y、Z都是有刺激性气味的气体,M是一种金属单质,D是一种盐,受热易分解。有以下转化关系,部分产物未标出。
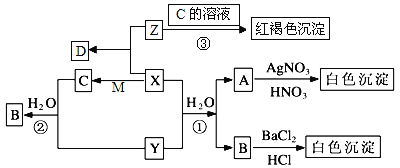
试回答:
(1)写出下列物质的化学式:X________、Y________、M________、D________。
(2)写出下列反应的离子方程式
①_______________________________________,
②_______________________________________,
③_______________________________________。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
选项 | A | B | C | D |
实验方案 |
|
|
|
|
目的 | 研究温度对化学平衡的影响 | 验证锌与硫酸铜反应过程中有电子转移 | 证明溶解度:AgCl>Ag2S | 比较不同催化剂对化学反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com