
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
科目:高中化学 来源: 题型:
【题目】用标准NaOH溶液滴定未知浓度的盐酸(盐酸放在锥形瓶中,NaOH放在滴定管中),用酚酞作指示剂,下列操作中会导致实验结果偏低的是 ( )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确.
A.①④B.②③⑤C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
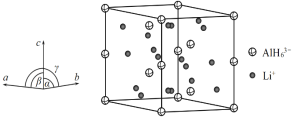
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
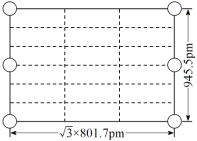
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构简式如下图所示。下列关于有机物X的说法正确的是

A. X化学式为C8H6O6
B. X可发生加成反应、水解反应和氧化反应
C. X分子中所有的原子一定在同一平面内
D. X能使溴水和KMnO4溶液褪色,原因均与分子中碳碳双键有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t℃时,某些物质的平衡常数K的值如表所示,下列说法错误的是( )
物质 | HCIO | H2CO3 | AgCl | AgI |
平衡常数 | Ka≈10﹣9 | K≈10﹣7 K≈10﹣11 | Ksp≈1.8×10﹣10 | Ksp≈8.51×10﹣17 |
A.向新制氯水中加入少量NaHCO3增强氯水漂白性
B.相同温度和浓度下,NaClO溶液的pH比Na2CO3溶液的pH小
C.t℃时,AgCl(s)+I﹣(aq)![]() AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
AgI(s)+Cl﹣(aq)的平衡常数K=2.1×106
D.将AgCl和AgI的饱和溶液等体积混合,再加入足量AgNO3溶液,会生成等量的AgCl和AgI沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除NO是环境治理的重大课题。回答下列问题:
(1)NaClO2氧化去除NO
已知:5 NaClO2(aq)+4HCl(aq)=4ClO2(g)+2H2O(l)+5NaCl(aq) △H1
5NO(g)+3ClO2(g)+4H2O(l)=5HNO3(aq)+3HCl(aq) △H2
则反应4NO(g)+3NaClO2(aq)+2H2O(l)=4HNO3(aq)+3NaCl(aq)
△H=_____(用含△H1、△H2的代数式表示)
(2)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为NO2﹣+S2O82﹣+2OH﹣NO3﹣+2SO42﹣+H2O。
不同温度下,平衡时NO2﹣的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。

①平衡时b、d两点的浓度:c(S2O82﹣)b_____c(S2O82﹣)d(填“>”、“<”或“=”)
②a、b、c三点平衡常数K由大到小的顺序为_____,原因是_____。
③常温下,反应中NO2﹣、S2O82﹣的初始浓度均为 x molL﹣1,反应达平衡时溶液pH=14,NO3﹣浓度为 y molL﹣1(忽略反应前后溶液体积的变化),该反应的化学平衡常数为_____。
(3)连二亚硫酸钠(Na2S2O4)还原去除NO。若用连二亚硫酸钠(Na2S2O4)溶液还原NO去除污染,再电解生成的NaHSO3,可再生Na2S2O4,其电解过程如图所示,质子膜允许H+和H2O通过。阴极的电极反应式为_____,将处理 n molNO后的溶液电解至恰好完全再生时,理论上生成的O2在标准状况下的体积为_____L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新材料的研制与应用始终是科技发展的主要方向之一。
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子的价层电子排布式是____。
(2)硼及其化合物广泛应用于永磁材料、超导材料等领域,硼可以与氟气反应生成BF3气体,BF3分子的立体构型为___________。
(3)石墨的晶体结构如图所示,如图虚线勾勒出的是其晶胞。则石墨晶胞含碳原了个数___________。碳的两种同素异形体中键长较短的是___________(填“石墨”或“金钢石”)。

(4)石墨烯(图甲〕是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)

图乙中,1号C的杂化方式是___________,该C与相邻C形成的键角___________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(5)有机太阳能固体电池材料含有高纯度C60,其分子结构如图,1molC分子中π键的数目为___________。C60能溶于二硫化碳而不溶于水的原因是___________。C60的晶胞与干冰的晶胞相似,已知该晶胞的密度为ρg·cm-3,则两个最近C60分子间的距离为___________nm(列出计算式,已知阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com