
【题目】一定温度下,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
A.单位时间内生成n mol ![]() ,同时生成n mol AB
,同时生成n mol AB
B.体系内的总压不随时间变化
C.单位时间内生成2n mol AB的同时生成![]()
D.单位时间内生成![]() 的同时,生成
的同时,生成![]()
【答案】C
【解析】
A、单位时间内生成n mol A2,即消耗2n mol AB,同时生成n mol AB,则正逆反应速率不相等,反应还未达到平衡状态,选项A错误;
B、由于方程式两边气体的化学计量数之和相等,气体的物质的量不变,所以压强始终不变,压强不变不能作为判断达到平衡状态的依据,选项B错误;
C、单位时间内生成2mol AB,即消耗n mol B2,同时生成n mol B2,表示的正逆反应速率相等,反应达到平衡,选项C正确;
D、任何时间内,单位时间内生成n mol A2的同时,一定也生成n mol B2,只表示逆反应的方向,不能说明反应达到平衡状态,选项D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
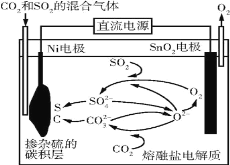
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,反应![]() 的平衡常数如下:
的平衡常数如下:
温度 | 207 | 387 |
平衡常数 |
|
|
下列说法正确的是( )
A.其正反应的![]()
B.207℃时,密闭容器中进行的该反应总压不变不可以作为该反应达到平衡的标志
C.387℃时,1L密闭容器中投入![]() mol的
mol的![]() ,平衡时转化率为
,平衡时转化率为![]()
D.387℃时,1L密闭容器中充入![]()
![]() mol、
mol、![]()
![]() mol和
mol和![]()
![]() mol,则反应将向正反应方向进行
mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了广泛而深入的研究。
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的下列复合氢化物其储氢能力由高到低的顺序是_______________(填标号)。
A.Mg(NH2)2 B.NaNH2 C.H3N-BH3 D.NaAlH4 E.Li3AlH6
(2)在Mg(NH2)2和NaNH2中均存在NH![]() ,NH
,NH![]() 的空间构型为____________,中心原子的杂化方式为___________。
的空间构型为____________,中心原子的杂化方式为___________。
(3)2019年Rahm利用元素价电子的结合能重新计算各元素的电负性,短周期主族元素的Rahm电负性数值如下表所示:
元素符号 | H | ||||||
Rahm电负性 | 13.6 | ||||||
元素符号 | Li | Be | B | C | N | O | F |
Rahm电负性 | 5.4 | 9.3 | 11.4 | 13.9 | 16.9 | 18.6 | 23.3 |
元素符号 | Na | Mg | Al | Si | P | S | Cl |
Rahm电负性 | 5.1 | 7.6 | 9.1 | 10.8 | 12.8 | 13.6 | 16.3 |
①写出基态B原子的价电子轨道表达式:______________________。
②通过上表可以推测Rahm电负性小于___________________的元素为金属元素。
③结合上表数据写出H3N-BH3与水反应生成一种盐和H2的化学方程式____________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7pm、c=945.5pm,α=β=90°、γ=120°,结构如图所示:
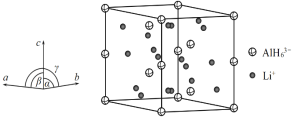
① 已知AlH![]() 的分数坐标为(0,0,0)、
的分数坐标为(0,0,0)、![]() 、
、![]() 、
、![]() 、
、![]() 和,
和,![]() ,晶胞中Li+的个数为____________。
,晶胞中Li+的个数为____________。
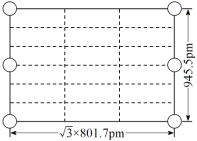
② 右图是上述Li3AlH6晶胞的某个截面,共含有10个AlH![]() ,其中6个已经画出(图中的O),请在图中用O将剩余的AlH
,其中6个已经画出(图中的O),请在图中用O将剩余的AlH![]() 画出_________________。
画出_________________。
③ 此晶体的密度为____________________________g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是
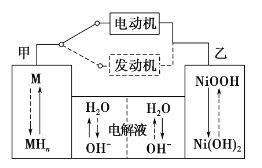
A.放电时甲为负极,充电时为阳极
B.放电时负极的电极反应式为:MHn-ne-=M+nH+
C.电池充电时,OH-由甲侧向乙侧移动
D.汽车下坡时发生图中实线所示的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com