
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
【答案】A
【解析】
A. 若X点P的体积分数40%,Y点P的体积分数小于40%,X点P的含量高,P为生成物,产率越大,平衡常数越大,两点的平衡常数分别为K1、K2,则K1>K2,故A正确;
B. 温度为T1时,设N的变化量为xmol,根据反应:
M(s)+2N(g)![]() P(g)+Q(g)
P(g)+Q(g)
初始(mol):1 2 0 0
变化(mol): x ![]()
![]()
平衡(mol): 2-x ![]()
![]()
温度为T1时,X点P的体积分数=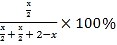 =40%,解得x=1.6mol。
=40%,解得x=1.6mol。
N的平衡转化率为=![]() =80%,平衡常数K=
=80%,平衡常数K=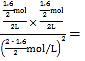 4,故B错误;
4,故B错误;
C. 该反应为反应前后气体体积不变的体系,压强不影响平衡移动,不能做为达到平衡的判断依据,故C错误;
D.该反应为反应前后气体体积不变的体系,增大压强,反应速率加快,但压强不影响平衡移动,转化率不变;根据“先拐先平数值大”的原则,T2> T1,降低温度P的体积分数减少,反应向逆向进行,即放热的方向进行,反应物的转化率较低,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 水电离的![]() =1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
=1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
B. ![]() =1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
=1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
C. 与Al反应能放出H2的溶液:Cu2+、NO3—、K+、SO42—
D. 无色溶液中:Cr2O72—、Na+、H+、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
A.单位时间内生成n mol ![]() ,同时生成n mol AB
,同时生成n mol AB
B.体系内的总压不随时间变化
C.单位时间内生成2n mol AB的同时生成![]()
D.单位时间内生成![]() 的同时,生成
的同时,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固氮作用有3种途径:生物固氮、人工固氮和大气固氮。如表列举了不同温度下大气固氮的部分平衡常数K值。![]() 时,向
时,向![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,10s时反应达到平衡。
,10s时反应达到平衡。
反应 | 大气固氮 | |
温度/℃ | 27 | 2260 |
K |
| 1 |
下列说法正确的是( )
A.大气固氮反应属于放热反应
B.10 s末,![]() 的转化率约为
的转化率约为![]()
C.10 s内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
D.10 s末,再向容器中充入![]() mol
mol ![]() 和
和![]() mol
mol ![]() ,
,![]() 的平衡转化率不变
的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种黄绿色气体,X、Y、Z都是有刺激性气味的气体,M是一种金属单质,D是一种盐,受热易分解。有以下转化关系,部分产物未标出。
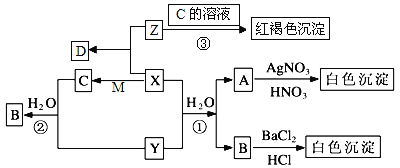
试回答:
(1)写出下列物质的化学式:X________、Y________、M________、D________。
(2)写出下列反应的离子方程式
①_______________________________________,
②_______________________________________,
③_______________________________________。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
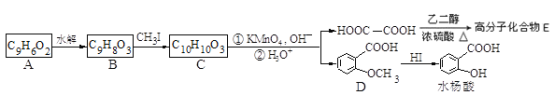
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)请写出基态Cu原子的价电子排布式_________。焰火中的绿色是铜的焰色,基态铜原子在灼烧时价电子发生了_________ 而变为激发态。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Il(Zn)______ Il(Cu)(填“大于”或“小于”),原因是___________。
(3)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式:

请分析1个松脂酸铜中π键的个数___________加“*”碳原子的杂化方式为_____________。
(4)硫酸铜溶于氨水形成![]() 4深蓝色溶液。
4深蓝色溶液。
① ![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
③氨的沸点_________________(填“高于”或“低于”)膦;
(5)黄铜合金可以表示为![]() ,为面心立方晶胞,晶体密度为8.5
,为面心立方晶胞,晶体密度为8.5![]() ,求晶胞的边长___________(只写计算式,不求结果)
,求晶胞的边长___________(只写计算式,不求结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com