
【题目】下列粒子半径最大的是( )
A.Na+
B.Al3+
C.S2﹣
D.Cl﹣
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 将稀硫酸加入到大苏打溶液中:S2O32-+2H+=S↓+SO2↑+H2O
B. 用铁为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 用浓盐酸酸化的KMnO4溶液与H2C2O4反应,反应的离子方程式为:2MnO4—+6H++5H2C2O4=2Mn2+ +10CO2↑ +8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮、硫、碳及其化合物的转化对于环境的改善有重大意义,可减少如雾霾天气、酸雨、酸雾等环境污染问题。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。
2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。

① 图1中C点时,SO2的转化率为_______。
② 图1中B点的压强平衡常数Kp=_______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。
5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。

①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是______________________________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(4)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图3所示,在催化剂b表面发生的电极反应为:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳有两种常见的同位素12C、13C;氧有三种常见的同位素16O、17O、18O.由这五种微粒构成的CO2分子中,其相对分子质量最多可能有( )
A.6种
B.10种
C.11种
D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,化学键类型完全相同的时( )
A.HCl 和NaOH
B.Na2O 和Na2O2
C.CaCl2 和 Na2S
D.CO2 和 CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计下图实验装置(夹带装置略去)制备Cl2,并探究氯气的相关性质。
已知: 硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂。
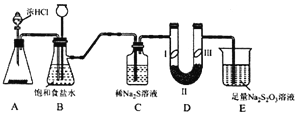
(1)若A装置中固体药品为KMnO4,产生标况下3.36L氯气时,被氧化的HCl的物质的量为___。
(2)装置B的作用是_____________。
(3)装置C的作用是探究氯气与Na2S溶液反应。反应开始后,观察到C中产生黄色沉淀。写出该反应的化学方程式_____________。
(4)装置D的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________、____________。
【探究与反思】
按图中设计装置进行实验,甲同学观察到C中先产生黄色沉淀。但是长时间通入氯气后,溶液又变澄清,该同学思考后设计如下实验检验C中生成物的成分。
实验操作步骤:
①取少量原Na2S溶液于小试管中,滴加BaCl2溶液,无明显现象;
②取少量反应后C中澄清溶液于小试管中,滴加过量的盐酸,无气泡冒出,再滴加BaCl2溶液,产生白色沉淀。
(5)该同学根据实验现象得出结论:装置C 中生成的含硫元素的物质是______ (填化学式)。推测过量的氯气与Na2S溶液反应的离子方程式为________________。
(6)请用离子方程式说明装置E的作用______________。
(7)乙同学认真思考后认为装置E中的试剂不合理。请用离子方程式和必要的文字解释原因:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com