
【题目】室温下,向25.00 mL 0.1000 molL1氨水中滴加0.1000 molL1盐酸,溶液的pH随盐酸体积的变化如图。下列说法不正确的是( )
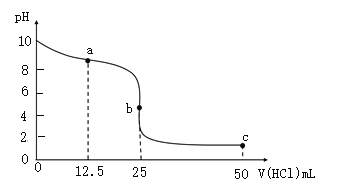
A.如选甲基橙为指示剂,终点的判断为溶液颜色由黄色恰好变为橙色且半分钟不变色
B.a→b,水的电离程度逐渐增大
C.a点溶液中,![]() c(H+)
c(H+)
D.c点溶液中,![]()
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A.参加反应的Fe2+全部作还原剂
B.每生成1 mol Fe3O4,被S2O32-还原的O2为0.5 mol
C.x=3
D.已知Fe3O4纳米颗粒直径为20 nm,则Fe3O4纳米颗粒为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴已知在周期表的某一周期,其零族元素的价层电子排布式为![]() ,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
⑵稀有气体的化合物![]() 分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
⑶硼酸能形成类似于石墨的层状结构,单层的结构如图所示
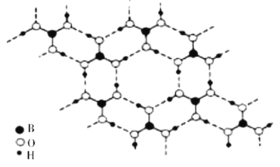
则硼酸晶体中存在的作用力除共价键外,还有_____________。
⑷稀土资源是重要的战略资源,下图为某稀土元素A的氧化物晶体的立方晶胞结构示意图,其中氧离子占据顶点、面心、棱心、体心的位置,A离子占据半数的立方体空隙
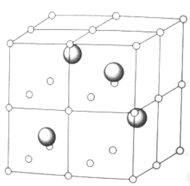
写出A氧化物的化学式______,A离子的配位数为______。已知晶胞参数为![]() ,则
,则![]() 间距为________
间距为________![]() ,设A的摩尔质量为
,设A的摩尔质量为![]() ,晶体的密度为_______
,晶体的密度为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
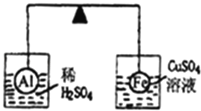
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用饱和电解食盐水来制取氯气.现取500mL含NaCl为11.7g的饱和食盐水进行电解.(已知2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-)
Cl2↑+ H2↑+ 2OH-)
(1) 在标准状况下制得Cl2多少升?
(2) 所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有FeSO4、Fe(NO3)3、Al(NO3)3、NH4Cl、 Na2CO3 中的几种,进行如下实验:
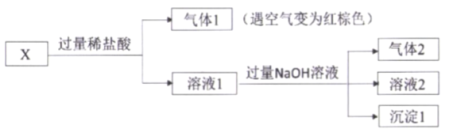
下列说法不正确的是
A.混合物X中必定含有NH4Cl、FeSO4,不含Na2CO3
B.灼烧沉淀1,可以得到红棕色物质
C.将足量的气体2通入溶液1中,将出现沉淀
D.往溶液2中通入足量的CO2,若没有出现沉淀,说明X中不含Al(NO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为___mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸___mL。
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:___;
②定容时仰视读数:___;
③用量筒量取浓硫酸时俯视___;
④移液时不慎将少量溶液滴在容量瓶外面:___。
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应___;
②加蒸馏水时不慎超过了刻度,应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下,H2 (g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件下的ΔH相同
2HCl(g)在光照和点燃条件下的ΔH相同
B. 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C. 已知:①2H2(g) +O2(g)![]() 2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)
2H2O(g)ΔH=-a kJ·mol-1,②2H2(g)+O2 (g)![]() 2H2O(l)ΔH=-b kJ·mol-1,则a>b
2H2O(l)ΔH=-b kJ·mol-1,则a>b
D. 已知:①C(s,石墨)+O2 (g)![]() CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)
CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)![]() CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)
CO2 (g)ΔH=-395.0 kJ·mol-1,则C(s,石墨)![]() C(s,金刚石)ΔH= -1.5 kJ·mol-1
C(s,金刚石)ΔH= -1.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com