
【题目】如图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为___mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸___mL。
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:___;
②定容时仰视读数:___;
③用量筒量取浓硫酸时俯视___;
④移液时不慎将少量溶液滴在容量瓶外面:___。
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应___;
②加蒸馏水时不慎超过了刻度,应___。
【答案】18.4 62.5 偏高 偏低 偏低 偏低 该用胶头滴管滴加 重新配制
【解析】
(1)根据![]() 计算溶液的浓度;
计算溶液的浓度;
(2)实验室没有240mL容量瓶,实验中应用250mL容量瓶,计算时,也用250mL;
(3)根据![]() 进行误差分析。
进行误差分析。
(1)由标签可知,该硫酸质量分数为![]() ,密度为
,密度为![]() ,故该硫酸的物质的量浓度
,故该硫酸的物质的量浓度![]() ,故答案为:
,故答案为:![]() ;
;
(2)需要由浓硫酸配制240mL 4.6mol·L-1的稀硫酸,实验室没有240mL容量瓶,实验中应用250mL容量瓶,计算时,也用250mL。设需要浓硫酸体积为V,根据稀释定律,![]() ,解得
,解得![]() ;故答案为:
;故答案为:![]() ;
;
(3)根据![]() 进行误差分析; ①未经冷却趁热将溶液注入容量瓶中,导致V偏小,因此c偏高,故答案为:偏高;
进行误差分析; ①未经冷却趁热将溶液注入容量瓶中,导致V偏小,因此c偏高,故答案为:偏高;
![]() 定容时仰视读数,导致V偏大,则c偏低,故答案为:偏低;
定容时仰视读数,导致V偏大,则c偏低,故答案为:偏低;
![]() 用量筒量取浓硫酸时俯视,导致n偏小,则c偏低,故答案为:偏低;
用量筒量取浓硫酸时俯视,导致n偏小,则c偏低,故答案为:偏低;
![]() 移液时不慎将少量溶液滴在容量瓶外面,导致n偏小,则c偏低,故答案为:偏低;
移液时不慎将少量溶液滴在容量瓶外面,导致n偏小,则c偏低,故答案为:偏低;
(4) ①向容量瓶中加入蒸馏水至距刻度线![]() 时,应该用胶头滴管滴加,故答案为:该用胶头滴管滴加;
时,应该用胶头滴管滴加,故答案为:该用胶头滴管滴加;
![]() 加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制,故答案为:重新配制。
加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制,故答案为:重新配制。


科目:高中化学 来源: 题型:
【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑

在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向25.00 mL 0.1000 molL1氨水中滴加0.1000 molL1盐酸,溶液的pH随盐酸体积的变化如图。下列说法不正确的是( )
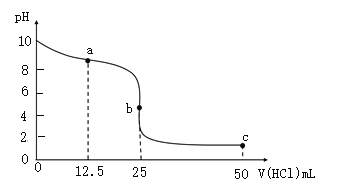
A.如选甲基橙为指示剂,终点的判断为溶液颜色由黄色恰好变为橙色且半分钟不变色
B.a→b,水的电离程度逐渐增大
C.a点溶液中,![]() c(H+)
c(H+)
D.c点溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较酸性相对强弱:H2SO4______HClO4(填“>”、“=”或“<”),已知能发生反应:H2SO4(浓)+NaClO4![]() HClO4+NaHSO4,说明该反应能发生的理由_______。
HClO4+NaHSO4,说明该反应能发生的理由_______。
(2)Al(OH)3具有一元弱酸的性质,在水中电离时产生的含铝微粒具有正四面体结构,写出电离方程式_______。
(3)甘氨酸和硝基乙烷的熔点分别为240°C和-40°C,从物质结构角度解释甘氨酸熔点较高的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究SO2与Fe3+能否发生氧化还原反应,按如图装置进行实验(夹持、加热仪器略),下列说法正确的是
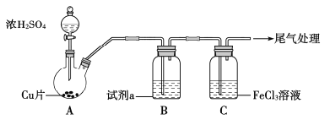
A.铜和浓硫酸反应需要加热的原因是低温下铜被钝化
B.试剂a为饱和NaHSO3溶液,其作用是观察气流速率
C.一段时间,向C中滴加氯化钡溶液,产生白色沉淀,说明Fe3+氧化了SO2
D.一段时间,向C中滴加酸性高锰酸钾,溶液褪色,说明SO2还原了Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g)![]() CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
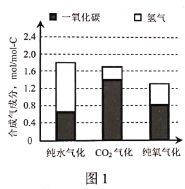
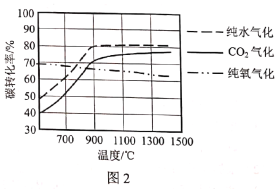
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
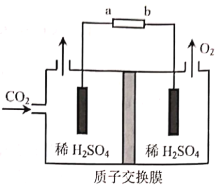
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com