
【题目】铋(Bi)是一种稀有金属,目前世界年产量约4000t左右。铋的主要用途是制造易熔合金,作为冶金添加剂及制药工业等方面。铋的冶炼分为粗炼和精炼两个阶段:
Ⅰ.粗炼
辉铋矿(Bi2S3) | 铋华(Bi2O3) | 混合精矿(Bi2S3/ Bi2O3) |
沉淀熔炼 | 还原熔炼 | 混合熔炼 |
Ⅱ.精炼
![]()
回答下列问题:
(1)铋在元素周期表中的位置是_______________。
(2)①还原熔炼法中还需加入一定量造渣剂(纯碱)使其与矿石中的脉石(主要为Al2O3)形成熔渣,写出形成熔渣反应的化学反应方程式______________________________。
②对于混合精矿,矿料中的Bi2S3和Bi2O3可在高温下彼此进行氧化还原反应生产粗铋,写出此反应的化学反应方程式______________________________。
③有些硫化铋矿也可用湿法处理,即加入三氯化铁与盐酸的混合液,可溶解硫化铋和少量天然铋,这是利用了_______________________________。
(3)电解精炼时,以_______作为阳极,__________作为阴极,电解液一般用FeCl3/HCl。此时电解出的铋还含有砷、锑、碲杂质,需进一步除去:
①除砷、锑

在熔融粗铋中通入空气,砷、锑将优先氧化为As2O3及Sb2O3,根据上图分析其原因是________________________________。
②除碲:向除砷、锑后的熔铋中继续鼓入空气并加入NaOH,杂质碲被氧化为TeO2随即被NaOH吸入形成亚碲酸钠,写出吸入反应的离子反应方程式_______________________。
【答案】第六周期ⅤA族 Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑ Bi2S3+Bi2O3
2NaAlO2+CO2↑ Bi2S3+Bi2O3![]() 6Bi+3SO2↑ 三氯化铁有氧化性(其他合理答案) 粗铋 精铋 相同温度下,生成此两种氧化物的反应更有利于自发进行(其他合理答案也给分)
6Bi+3SO2↑ 三氯化铁有氧化性(其他合理答案) 粗铋 精铋 相同温度下,生成此两种氧化物的反应更有利于自发进行(其他合理答案也给分) ![]()
【解析】
(3)电解精炼时,需要被提纯的金属作为阳极被氧化成阳离子,再在阴极被还原以达到精炼的目的;
①根据△G=△H-T△S<0时反应可以自发进行进行分析;
②Te与S元素同主族,亚碲酸根应为TeO![]() 。
。
(1)Bi元素为83号元素,与N、P等元素同主族,位于元素周期表第六周期VA族;
(2)①Al2O3是两性氧化物,与纯碱(Na2CO3)反应时应表现酸性,参考二氧化硅和碳酸钠的反应可知该反应生成偏铝酸钠和二氧化碳,根据元素守恒可得化学方程式为Al2O3+ Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②Bi2S3和Bi2O3可在高温彼此进行氧化还原反应生产粗铋,结合元素守恒和价态规律,可知还会生成SO2,所以化学反应方程式为Bi2S3+Bi2O3![]() 6Bi+3SO2↑;
6Bi+3SO2↑;
③三氯化铁有氧化性,可以氧化硫化铋中的S元素,使其溶解;
(3)电解精炼时,需要将Bi3+还原以得到精铋,电解池中阴极发生还原反应,所以精铋作为阴极,同时粗铋作为阳极,被氧化成阳离子,再在阴极被还原以达到精炼的目的;
①△G=△H-T△S<0时反应可以自发,越小越容易自发进行,据图可知相同温度下,生成此两种氧化物的反应更有利于自发进行;
②参考SO2和NaOH的反应可知TeO2别NaOH吸入的反应方程式为![]() 。
。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入5mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
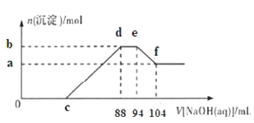
A.硝酸的还原产物全部是![]() B.b点与a点的差值为0.05mol
B.b点与a点的差值为0.05mol
C.原硝酸溶液中硝酸的物质的量为0.47molD.样品中铝粉和铁粉的物质的之比为5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A.参加反应的Fe2+全部作还原剂
B.每生成1 mol Fe3O4,被S2O32-还原的O2为0.5 mol
C.x=3
D.已知Fe3O4纳米颗粒直径为20 nm,则Fe3O4纳米颗粒为胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
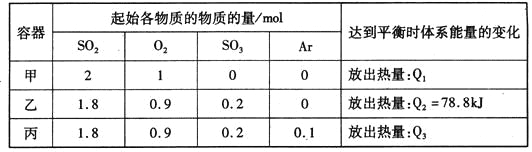
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴已知在周期表的某一周期,其零族元素的价层电子排布式为![]() ,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
,同周期的A、B两种元素,最外层电子数为2、7,次外层电子数为8、18,则元素A为________,B为________(写元素符号)。若周期表有第8周期,则其最终的零族元素的原子序数为____________。
⑵稀有气体的化合物![]() 分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
分子的空间构型是__________,写出与其互为等电子体的一种阴离子的化学式___________。
⑶硼酸能形成类似于石墨的层状结构,单层的结构如图所示
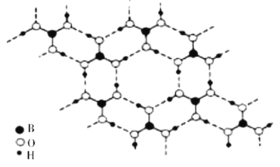
则硼酸晶体中存在的作用力除共价键外,还有_____________。
⑷稀土资源是重要的战略资源,下图为某稀土元素A的氧化物晶体的立方晶胞结构示意图,其中氧离子占据顶点、面心、棱心、体心的位置,A离子占据半数的立方体空隙
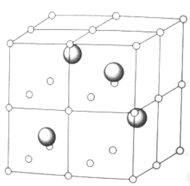
写出A氧化物的化学式______,A离子的配位数为______。已知晶胞参数为![]() ,则
,则![]() 间距为________
间距为________![]() ,设A的摩尔质量为
,设A的摩尔质量为![]() ,晶体的密度为_______
,晶体的密度为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
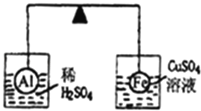
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为___mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸___mL。
(3)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填偏高偏低或无影响)?
①未经冷却趁热将溶液注入容量瓶中:___;
②定容时仰视读数:___;
③用量筒量取浓硫酸时俯视___;
④移液时不慎将少量溶液滴在容量瓶外面:___。
(4)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应___;
②加蒸馏水时不慎超过了刻度,应___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com