
【题目】氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:____________。
(2)与N3-互为等电子体的分子有:______(写一种)由此可推知N3-的空间构型是:_________; 比较NH2-和NH3的键角∠HNH的大小:NH2- ____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释_______。
(3)叠氮化钠(NaN3)分解可得纯N2,有关说法正确的是:________(选填代号)
A.氮气常温下很稳定,是因为氮元素的电负性大
B.NaN3与KN3结构类似,前者晶格能较小
C.第一电离能(I1):N>P>S
D.热稳定性NH3强于PH3和H2S是因为NH3分子间有氢键
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3 = 3Na2O + 2Fe+ 9N2 ;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如下图所示):

晶胞甲中铁原子的配位数为:_______,晶胞乙中铁原子的堆积方式为:________。晶胞乙中铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为M g/mol。则该晶体的密度可表示为:___________ g/cm3。
【答案】2NaNH2+N2O = NaN3+NaOH+NH3 N2O或CO2或CS2或BeCl2 直线形 < NH2-中N原子孤对电子数为2,NH3中N原子孤对电子数为1,孤对电子数前者多于后者,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,所以键角前者小 C 8 面心立方最密堆积 ![]()
【解析】
(1)根据质量守恒定律来判断反应产物的化学式,再写出反应的方程式;
(2)原子个数相等且价电子相等的微粒为等电子体;根据等电子体的结构相似来分析;根据孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力来分析;
(3)A. N2常温下很稳定,是因为分子内共价键较强;
B. 离子半径越小,晶格能越大;
C. 同周期从左向右,第一电离能增大,但第VA族因p轨道上有3个电子,半充满结构,所以第一电离能高于相邻族的元素,同主族从上到下第一电离能逐渐减小,据此判断;
D. 热稳定性NH3强于PH3和H2S是因为N原子半径小,共价键键能大,与分子间的氢键无关,据此判断;
(4)根据晶胞甲示意图可知原子占据立方体的顶点和体心,可知为体心立方堆积,配位数为8;图乙为面心立方最密堆积,该晶胞中Fe原子个数=8×![]() +6×
+6×![]() =4,每个晶胞的质量=
=4,每个晶胞的质量=![]() ×4,Fe原子的直径为2acm,晶胞的边长为
×4,Fe原子的直径为2acm,晶胞的边长为![]() a,体积为16
a,体积为16![]() a3,由
a3,由![]() =
=![]() 计算晶胞的密度。
计算晶胞的密度。
(1)根据质量守恒定律可知,反应前后原子的种类和数目不变,可确定气体产物为NH3,NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和NH3。方程式为:2NaNH2+N2O = NaN3+NaOH+NH3;
(2)N3-中原子个数为3,价电子数为16,因此与N3-互为等电子体的微粒有:N2O、CO2、CS2、BeCl2、SCN-、OCN-、CNO-等;CO2属于直线形分子,等电子体的结构相同,因此N3-为直线形分子;孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,NH2-中N原子孤对电子数为2,NH3中N原子孤对电子数为1,孤对电子数前者多,所以前者键角小;
(3)A. N2常温下很稳定,是因为分子内共价三键,键能较大,A项错误;
B. 离子半径越小,晶格能越大,NaN3的晶格能大于KN3的晶格能,B项错误;
C. 同周期从左向右,第一电离能增大,但第VA族因p轨道上有3个电子,半充满结构,所以第一电离能高于相邻族的元素,同主族从上到下第一电离能逐渐减小,因此N、P、S的第一电离能的顺序为N>P>S,C项正确;
D. 热稳定性NH3强于PH3和H2S是因为N原子半径小,共价键键能大,与分子间的氢键无关,D项错误;
答案选C;
(4)根据晶胞甲示意图可知原子占据立方体的顶点和体心,可知为体心立方堆积,配位数为8;图乙为面心立方最密堆积;该晶胞中Fe原子个数=8×![]() +6×
+6×![]() =4,每个晶胞的质量=
=4,每个晶胞的质量=![]() ×4,Fe
×4,Fe![]() a,体积为16
a,体积为16![]() a3,因此
a3,因此![]() =
=![]() =
=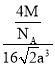 =
=![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
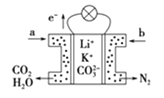
A.a为C4H10,b为CO2
B.在熔融电解质中,CO32-向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是( )

A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl-向乙池移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:

(1)硼在元素周期表中的位置为:____________________________________;
(2)硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图a是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,投影在同一平面上。根据图示确定硼化镁的化学式为_____________。
(3)硼酸(H3BO3),白色片状晶体,微溶于水,对人体的受伤组织有防腐消毒作用。H3BO3溶液中存在H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)的平衡。硼酸和过量的NaOH溶液反应方程式为:H3BO3+NaOH=Na[B(OH)4]。硼酸晶体具有层状结构,每一层结构如图1所示。
[B(OH)4]-(aq)+H+(aq)的平衡。硼酸和过量的NaOH溶液反应方程式为:H3BO3+NaOH=Na[B(OH)4]。硼酸晶体具有层状结构,每一层结构如图1所示。
①硼酸晶体属于_______晶体(填“离子”、“分子”或“原子”)。
②下列关于硼酸的说法正确的是_______________(填序号)。
a.H3BO3是一元酸
b.其水溶液中,水的电离平衡受到抑制
c.晶体中有氢键,因此硼酸分子较稳定
(4)三氟化硼(BF3)水解生成硼酸和氟硼酸(HBF4,强酸)。BF3分子立体构型为___________,BF4-的电子式____________。
(5)氨硼烷(NBH6)是一种有效、安全的固体储氢材料。氨硼烷的结构(如图b)和乙烷相似,氨硼烷分子与硼酸分子中硼原子的杂化轨道类型分别为:___________和___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,在工业上用![]() 和冰晶石
和冰晶石![]() 混合熔电解制得。
混合熔电解制得。
Ⅰ.铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:

(1)写出反应1中涉及的任意一个化学方程式______;
(2)滤液Ⅰ中加入的CaO生成的沉淀是_____,已知气体A在标准状况下的密度为1.96g/L,反应2的离子方程式为______;
Ⅱ.以萤石![]() 和纯碱为原料制备冰晶石的流程如下:
和纯碱为原料制备冰晶石的流程如下:

(3)萤石![]() 的电子式______;
的电子式______;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是______,写出由D制备冰晶石![]() 的化学方程式_______;
的化学方程式_______;
(5)工业电解制铝若以石墨为电极,阳极产生的混合气体的成分是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
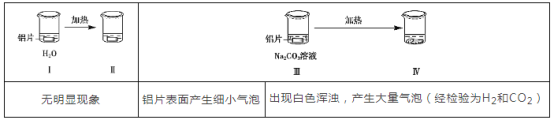
下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组以苯酚、苯和乙醇性质的比较为例,分析与实验探究有机化合物分子中的基团与性质的关系,以及基团之间存在相互影响。
(1)苯酚、苯和乙醇物理性质比较:以水溶性为例
乙醇 | 苯 | 苯酚 | |
水溶性 | 与水以任意比互溶 | 不溶于水 | 室温下,在水中溶解度是9.3g,当温度高于65℃时,能与水混溶 |
试分析苯酚、苯和乙醇水溶性差异的原因______。
(2)实验发现苯不和氢氧化钠反应,理论计算与实验发现:室温下苯酚的饱和溶液pH≈5,此时所测蒸馏水pH在5~6。考虑到空气中二氧化碳的影响,该小组认为需进一步实验以确认苯酚的酸性。
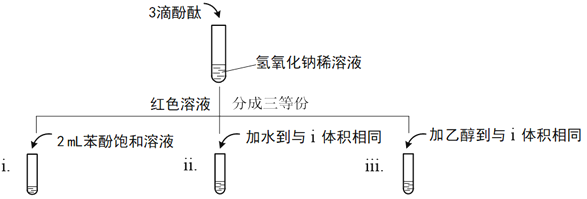
①写出苯酚与氢氧化钠反应的化学方程式______。
②证明苯酚显酸性的实验现象是______。
③苯不显酸性、乙醇不显酸性,苯酚中的羟基具有酸性是因为______。
(3)设计实验并结合实验现象证明苯酚中羟基对苯环的影响______。(文字描述、画图等均可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的二种酸HX、
的二种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如下表,下列判断正确的是
,实验数据如下表,下列判断正确的是![]()
数据编号 | NaOH加入的体积 | 溶液的pH | |
|
| ||
① | 0 | 3 | 1 |
② | a | 7 | |
③ |
| x | y |
A.在相同温度下,同浓度的两种酸溶液的导电能力顺序![]()
B.由表中数据可估算出![]()
C.HY和HX混合,![]()
D.上述②反应后的HY溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com