
【题目】下列说法不正确的是
A.铅蓄电池在放电过程中,正极得到电子,电极质量增加
B.0.1mol/L CH3COOH溶液加水稀释后,溶液中![]() 减小
减小
C.SiO2(s)+2C(s)=Si(s)+2CO(g)必须在高温下反应才能发生,则ΔH>0
D.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3(g)+5O2(g)== 4NO(g)+6H2O(g),该反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的平均速率为 ( )
A. V(O2)=0.01molL-1s-1B. V(NO)=0.008 molL-1s-1
C. V(H2O)=0.003 molL-1s-1D. V(NH3) =0.003 molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
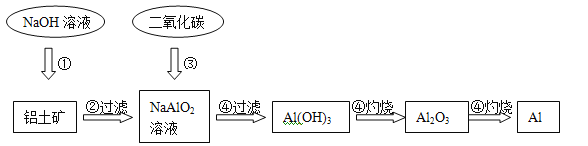
(1)请用离子方程式表示以上工艺流程中第①步反应:__ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:_ _____。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途_____________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
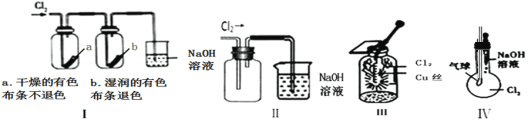
A.图I中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.图II中:收集氯气
C.图IV中:若气球干瘪,证明可与NaOH溶液反应
D.图III中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
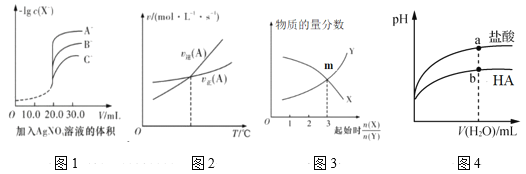
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
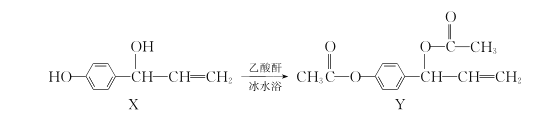
下列说法正确的是
A.Y中有3种不同官能团
B.X、Y分子中均含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH+Cl2===KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2===5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________;
(3)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是______
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com