
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
(1)基态O原子核外电子排布式为_______,基态Fe2+核外未成对电子数为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;
(2)比较大小(填“大于”、“小于”或“等于”):
①沸点:NH3_____PH3 ;②第一电离能:I1(P)_____I1(O)。
(3)PO43的空间构型是______,P原子的杂化形式为______,在1molPO43中含σ键______个。
(4)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
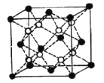
【答案】1s22s22p4 4 纺锤 大于 小于 正四面体 sp3 4NA ![]()
【解析】
(1)根据电子排布规律书写;
(2)借助硫元素的位置,根据第一电离能的变化规律判断。
(3)根据价层电子互斥理论分析离子的空间构型和原子的杂化方式。
(4)根据晶胞的均摊法分析计算晶体的密度。
(1)基态氧原子的电子排布式为 1s22s22p4;基态Fe2+核外电子排布式为1s22s22p63s23p63d6,其中未成对电子数为4;基态P原子核外占据最高能级的电子为3p电子,其电子云轮廓图为纺锤形;
(2) ①氮的非金属性比磷强,所以氨气的稳定性大于磷化氢;
②同主族元素,从上往下第一电离能减小,同周期元素,从做到右,第一电离能增大,所以磷的第一电离能小于硫,硫小于氧。故I1(P) 小于I1(O);
(3)磷酸根离子中磷原子价层电子对个数为![]() ,且不含孤对电子,根据价层电子对互斥理论判断该阴离子为正四面体;中心原子磷原子杂化形式为 sp3;磷氧单键为σ键,磷氧双键为σ键和π键,所以一个磷酸根离子含有4个σ键,故1mol磷酸根离子含有 4NAσ 键。
,且不含孤对电子,根据价层电子对互斥理论判断该阴离子为正四面体;中心原子磷原子杂化形式为 sp3;磷氧单键为σ键,磷氧双键为σ键和π键,所以一个磷酸根离子含有4个σ键,故1mol磷酸根离子含有 4NAσ 键。
(4)由图可知,锂位于晶胞内部,氧位于顶点和面心,因此一个晶胞中有8个锂原子,氧原子个数为![]() =4,因此一个氧化锂晶胞的质量为
=4,因此一个氧化锂晶胞的质量为![]() g,一个晶胞的体积为(0.4665
g,一个晶胞的体积为(0.4665![]() )3cm3,即晶体的密度为
)3cm3,即晶体的密度为![]() g·cm3。
g·cm3。


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v (PCl3) = 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3) = 0.11 mol·L-1,则反应的ΔH < 0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正) < v (逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl5,达到平衡时PCl5的转化率小于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.常温常压下,200 g质量分数为17% 的H2O2溶液中含氧原子数目为NA
C.5.4g铝与足量NaOH溶液反应电子转移数为0.6NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室做了4个实验:将对应图象的序号写在实验变化情况后的横线上:
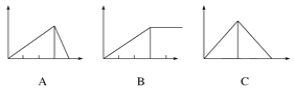
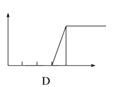
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况 ______,并写出相关的离子方程式_____________.
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________,写出AlCl3溶液与过量NaOH溶液的离子方程式____________.
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况 _____ .
(4)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是( )

A.若A为Fe,C为氢气,则B一定是酸
B.若A为H2O,B、D为化合物,则C一定是气体单质
C.若C为单质,D为化合物,则A、B中一定有一种物质是单质
D.若D为单质,A、B为化合物,该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种同体混合物,试回答下列问题:
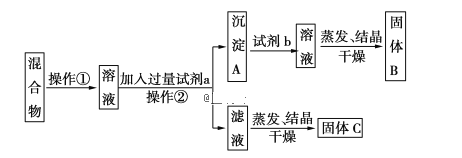
(1)操作①的名称是___________,操作②的名称是__________________。
(2)试剂a是____________(填化学式,下同),固体B是____________。
(3)加入试剂b所发生反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是
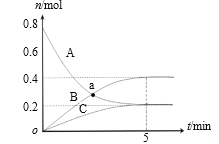
A.a点时,υ(A) =υ(B)
B.反应开始到5min,B的物质的量增加了0.2 mol
C.反应的化学方程式为:3A![]() 2B+C
2B+C
D.反应开始到5min,υ(C) =0.04 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)B.10(2a-b)C.10(b-a)D.10(b-2a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com