
| A、用酒精萃取碘水中的碘 |
| B、用分液的方法除去NaCl溶液中含有的少量氢氧化铁胶体 |
| C、用溶解、过滤、蒸发的方法提纯含有少量CaCO3的KCl |
| D、用加硫酸钠溶液再过滤的方法提纯含少量硝酸钡的硝酸钾溶液 |
科目:高中化学 来源: 题型:
| A、聚氯乙烯塑料制品可用于包装食品 |
| B、乙二醇可用于配制汽车防冻液 |
| C、部分卤代烃可用作灭火剂 |
| D、三硝基甲苯是一种黄色烈性炸药,常用于国防和民用爆破 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
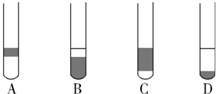
A、 装置用于Cu和浓H2SO4制取少量的SO2气体 |
B、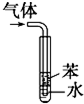 用于吸收HCl气体能防倒吸 |
C、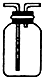 可用于收集气体H2、CO2、Cl2、NH3 |
D、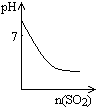 表示将SO2气体通入溴水中,所得溶液的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、3:8 |
| C、1:4 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、曲线A是向NaAlO2溶液中滴入盐酸至过量 |
| B、曲线B是向澄清石灰水中通入CO2至过量 |
| C、曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、曲线D是向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
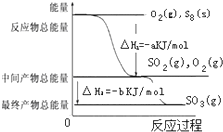 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )| A、S8(s)的燃烧热△H=-8akJ?mol-1 |
| B、2SO3(g)?2SO2(g)+O2(g);△H=-2b kJ?mol-1 |
| C、S8(s)+8O2(g)=8SO2(g);△H=-a kJ?mol-1 |
| D、由1molS8(s)生成SO3(g)的反应热△H=-(a+b)kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O(g)=H2 (g)+
| ||
| B、2H2 (g)+O2(g)=2H2O(l)△H=-484 kJ∕mol | ||
C、H2 (g)+
| ||
| D、2H2 (g)+O2(g)=2H2O(g)△H=+484 kJ∕mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com