
����Ŀ������ƽ����ϵmA(g)+nB(g)=C(g)+gD(g)����H<0�����н����д�����ǣ� ��
A.���¶Ȳ��䣬�������������С��ԭ����һ�룬��ʱA��Ũ��Ϊԭ����2.1������m+n<p+q
B.��m+n=p+q����������amol�����ƽ����ϵ���ټ���amol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
C.���¶Ȳ��䣬ѹǿ����ԭ����2�����ﵽ��ƽ��ʱ�������һ����ԭ����![]() ҪС
ҪС
D.��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
���𰸡�C
��������
��������mA(g)+nB(g)=C(g)+gD(g)����H<0��֪�����⿼�黯ѧƽ���ƶ�֪ʶ��������������ԭ��������
A.�������������С��ԭ����һ�룬������ƽ���ƶ�����ʱA��Ũ�ȱ�Ϊԭ����2��������A��Ũ��Ϊԭ����2.1����˵��ƽ����������A�ķ����ƶ��ˣ������С������ѹǿ��ƽ���������������С�ķ�����У�����m+n<p+q��A����ȷ��
B. ������amol�����ƽ����ϵ���ټ���amol��B��ƽ��������Ӧ�ƶ�������m+n=p+q���ﵽ��ƽ��ʱ��������ܵ����ʵ������䣬�ﵽ��ƽ��ʱ����������ʵ�������2amol��B����ȷ��
C. ���÷�Ӧ�У�m+n=p+q���¶Ȳ���ʱ��ѹǿ����ԭ����2����ƽ�ⲻ�ƶ����������Ϊԭ����![]() ��C�����
��C�����
D.��Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm:n��ǡ�õ��ڷ���ʽ��ϵ��ֵ�ȣ����������ƽ��ʱ��A��B��ת������ȣ�D����ȷ��
��ѡC��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L�ĺ����ܱ������з�����Ӧ![]() ����Ӧ�����еIJ����������±���ʾ��
����Ӧ�����еIJ����������±���ʾ��
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
����˵����ȷ���ǣ� ��
A.0~5 min��A��ʾ��ƽ����Ӧ����Ϊ![]()
B.�÷�Ӧ��10 min��Ŵﵽƽ��
C.ƽ��״̬ʱ��![]()
D.����B��ƽ��ת����Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ�ֻ���ɫ���壬������ˮ���ڻ�������е������������10���Ϳ��ܷ�����ը���ڹ�ҵ�ϳ�����ˮ��������Ư�����ش��������⣺
��1��ijС�����������ͼ��ʾ��ʵ��װ�������Ʊ�ClO2��
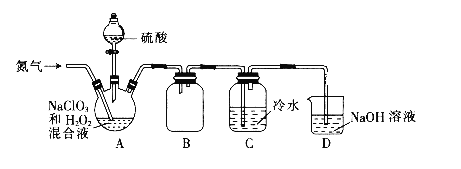
��ͨ�뵪������Ҫ������2����һ�ǿ����������ã�����__________��
��װ��B��������_________��
��������װ��C�е���Һ������ʱӦ���еIJ�����________��
��2����0.1000mol��L��1��Na2S2O3��Һ�ⶨװ��C��ClO2��Һ��Ũ�ȡ�ԭ����2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
������0.1000molL-1��Na2S2O3����Һʱ��������������ͼ��ʾ�������н���ѡ���⣬�����õ��IJ���������________�����������ƣ�
����ʵ����������������ȷ��������ʱ���ӿ̶��ߣ���������ҺŨ��___0.1000molL-1������>������<������=������ͬ������Na2S2O3����Һ��ת��������ƿʱ����������������������ҺŨ��___0.1000molL-1��
��ȡ10mLC����Һ����ƿ�У�����������KI��Һ��H2SO4�ữ��Ȼ�����___________��ָʾ������ñ�Һ���ĵ����Ϊ20.00mL��ͨ�������֪C��ClO2��Һ��Ũ��Ϊ________ mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ��Na��NaOH��NaHCO3�ֱ�������ʵ����ĸ�����ǡ�÷�Ӧʱ��Na��NaOH��NaHCO3�����ʵ���֮��Ϊ(����)
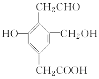
A. 3��3��2B. 3��2��1
C. 1��1��1D. 3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о����ְ�����Ϣ���У�![]() (2��4-����-1-��ϩ)��
(2��4-����-1-��ϩ)��![]() (3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
(3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
A��2��4-����1��ϩ�ķ���ʽΪC9H18
B��2��4-����-1-��ϩ��3��7-����-1-��ϩ��Ϊͬϵ��
C������������Ϣ�ؾ���ʹ������Ȼ�̼��Һ��ɫ
D��1 mol�Ҳϵ�����Ϣ����1 mol Br2�ӳɣ�����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������(NiC2O4��2H2O)������ˮ����ҵ�ϴӷ�������(��Ҫ�ɷ�ΪNi������һ������Al2O3��FeO��SiO2��CaO��)�Ʊ������������������ͼ��ʾ��

��֪������ؽ������������������������pH���������ݣ�
�������� | Fe3�� | Fe2�� | Al3�� | Ni2�� |
��ʼ������pH | 1.1 | 5.8 | 3.0 | 6.8 |
��ȫ������pH | 3.2 | 8.8 | 5.0 | 9.5 |
��Ksp(CaF2)��1.46��10-10��
�۵�ij����Ũ��С��1.0��10-5 mol��L-1ʱ����Ϊ��ȫ������
��ش��������⣺
��1������������л��ʵ��������Ũ�Ȳ����Ͽ��ٽ��裬Ŀ����______________��
��2��д����������ʱ������Ӧ�����ӷ���ʽ��______________________________����Ca2��������ȫʱ����Һ�� c(F-)> ________mol��L-1(д������ʽ����)��
��3���Լ�a��һ����ɫ��������д����������ʱ��Ӧ�Ļ�ѧ��Ӧ����ʽ��_______________________________��
��4������a�����ݰ������ˣ�ϴ�ӣ�������ü����������ϴ�ӵķ�����__________________________��
��5������pH��ʱpH�ĵ��ط�ΧΪ______��PH<6.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)�ֳ��������ǻ�����õĸ���ȼ�ϣ�������ΪҺ�壬���������ģ����ͼ��ʾ��������˫��ˮ������Ӧ N2H4��2H2O2��N2��4H2O���� NA��ʾ�����ӵ�������ֵ������˵����ȷ����
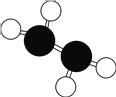
A.N2H4���ڹ��ۻ����������ֻ���м��Թ��ۼ�
B.��״���£�22.4 L N2H4�к��е�ԭ������Ϊ 6NA
C.��״���£�3.2 g N2H4�к��й��ۼ�������Ϊ 0.6NA
D.������ 3.6g H2O����������Ӧת�Ƶ��ӵ���ĿΪ 0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ת���Թ�ũҵ������������������Ҫ�����塣
��1�������ǵ����������ڼ��ֲ�ͬ����µ�ת����
����֪��2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6kJ��mol��1
2SO3(g) ��H����196.6kJ��mol��1
2NO(g)��O2(g)![]() 2NO2(g) ��H����113.0kJ��mol��1
2NO2(g) ��H����113.0kJ��mol��1
��SO2������NO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽΪ___��
��a.����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ�䷴Ӧ�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ1��ʾ����Ӧ��c��___(�����ﵽ������δ����)ƽ��״̬��
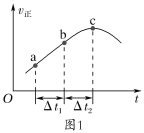
b.��ʼʱ���ֱ��ڸ������м����2molSO2(g)��2molNO2(g)����2molSO3(g)��2molNO(g)����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������__(����>������������<��)��
��2������ʱ��Ũ��Ϊ0.1mol��L-1���ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ����Һ��pH����������ı仯������ͼ2��ʾ��d�㴦������Һǡ����ȫ��Ӧ������ͼ2�ش��������⣺
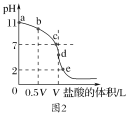
��b��c��d�����Ӧ����Һ�У�ˮ�����c(OH��)�ɴ�С��˳��Ϊ____��
�ڵζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������___��
a.![]() b.
b.![]()
c.![]() d.
d.![]()
�۸��¶�ʱ��ˮ�ĵ���ƽ�ⳣ��K��___��
��3����������������Ⱦ��������������������Һ���ա������ķ�ӦΪ��
2NaOH��NO��NO2=2NaNO2��H2O
2NaOH��2NO2=NaNO3��NaNO2��H2O
����Ӧ���Һ������������Һ�ֱ�ӵ���ͼ3��ʾ�ĵ����н��е�⣬A�Ҳ���N2��
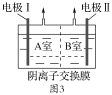
�ٵ缫����__����B�Ҳ�����������___��
��A��NO2-�����ĵ缫��Ӧ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH2CH2Br�Ʊ�CH3CH(OH)CH2OH�����η����ķ�Ӧ���ͺͷ�Ӧ��������ȷ����
ѡ�� | ��Ӧ���� | ��Ӧ���� |
A | �ӳɡ�ȡ������ȥ | KOH����Һ/���ȡ�KOHˮ��Һ/���ȡ����� |
B | ��ȥ���ӳɡ�ȡ�� | NaOH����Һ/���ȡ����¡�KOHˮ��Һ/���� |
C | ������ȡ������ȥ | ���ȡ�KOH����Һ/���ȡ�KOHˮ��Һ/���� |
D | ��ȥ���ӳɡ�ˮ�� | NaOHˮ��Һ/���ȡ����¡�NaOH����Һ/���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com