
| A、大于10 | B、小于10 |
| C、等于10 | D、无法确定 |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
| A、干冰升华要吸收大量的热,但不是化学反应中的吸热反应 |
| B、酒精常被用做酒精灯和内燃机的燃料,说明酒精燃烧是放热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时放出的能量 |
| D、常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水,浓H2SO4 |
| B、KMnO4酸性溶液,浓H2SO4 |
| C、溴水,烧碱溶液,浓硫酸 |
| D、NaOH溶液,浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 | H2 | NH3 | |
| ′起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量指的是物质所含构成粒子数的多少,它的单位是“摩尔” |
| B、1mol H2O含有6.02×1023个水分子 |
| C、1mol H2O的质量是18g |
| D、1mol H2O蒸汽的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中必须含有金属阳离子 |
| B、物质中化学键被破坏,则一定发生化学变化 |
| C、NaCl的结构式为Na-Cl |
| D、H2O的沸点高于H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L氦气所含原子数为NA | ||
| B、2.3g金属钠变为钠离子时失去的电子数为0.1NA | ||
| C、常温常压下,44g CO2的质子数为15NA | ||
D、标准状况下,a L的氧气和氮气的混合物含有的分子数约为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2?2SO3
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2?2SO3查看答案和解析>>
科目:高中化学 来源: 题型:
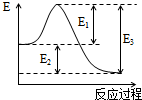 (1)如图为表示某反应过程的能量变化曲线.
(1)如图为表示某反应过程的能量变化曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com