
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
⑴①在元素周期表中,元素Y位于第___________周期第___________族,元素X位于___________区;
②Z所在周期中,第一电离能最大的元素是___________;(填元素名称)
③X+的核外电子排布式为___________;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有___________(填元素符号)
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是___________(填化学式)
⑵X与Y所形成化合物晶体的晶胞如图所示。
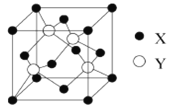
①在1个晶胞中,X离子的数目为___________
②该化合物的化学式为___________
⑶X与W的最高价含氧酸的浓溶液反应的化学方程式为___________
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是___________
②稳定性:H2Z___________H2W(填“<”、“>”或“=”),其主要原因是___________
【答案】三 ⅦA ds 氖 1s22s22p63s23p63d10 Cr HClO4 4 CuCl Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似 > H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H-O键的键长小于H-S键的键长也行)
CuSO4+SO2↑+2H2O 水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似 > H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H-O键的键长小于H-S键的键长也行)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1,则X为Cu,元素Y基态原子的3p轨道上有5个电子,则Y为Cl,元素Z的原子最外层电子数是其内层的3倍,则Z为O,元素W基态原子核外电子共有16种运动状态,则W为S。
⑴①在元素周期表中,元素Y(Cl)位于第三周期第ⅦA族,元素X(Cu)核外电子排布式为1s22s22p63s23p63d104s1,位于ds区;故答案为:三;ⅦA;ds。
②Z所在周期,是第二周期,第一电离能最大的元素是Ne;故答案为:氖。
③元素X(Cu)核外电子排布式为1s22s22p63s23p63d104s1,Cu+的核外电子排布式为1s22s22p63s23p63d10;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr;故答案为:1s22s22p63s23p63d10;Cr。
④同周期从左到右非金属性增强,最高价氧化物对应水化物酸性增强,因此Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是HClO4;故答案为:HClO4
⑵①在1个晶胞中,X离子的数目为![]() ;故答案为:4。
;故答案为:4。
②根据图中结构得到X离子有4个,Y离子有4个,该化合物的化学式为CuCl;故答案为:CuCl。
⑶X与W的最高价含氧酸的浓溶液反应即铜和浓硫酸加热反应,其化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是水与乙醇存在分子间氢键,而且水与乙醇分子中均有羟基,结构相似;故答案为:水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似。
②非金属性越强,简单氢化物的稳定性越强,因此稳定性:H2O>H2S;故答案为:>;H2O分子内H—O的键能大于H2S分子内H—S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H—O键的键长小于H—S键的键长也行)。


科目:高中化学 来源: 题型:
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
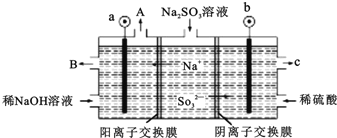
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___。
(2)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(3)SO32放电的电极反应式为___。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___。
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(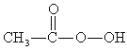 )是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
)是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
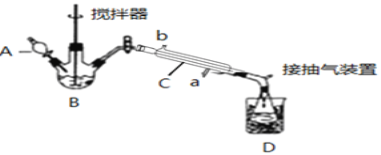
请回答下列问题:
(1)仪器B的名称是__;仪器C中冷水流入口是__(填a或b);
(2)为更好地控制反应温度,应采用方法是__;
(3)生成过氧乙酸的化学方程式为__;
(4)不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是__,反应所需时间约__(选填1、3、5、7)小时;
反应物比例CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2∶1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1∶1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1∶2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(5)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率;可供选择的试剂和主要器材有:a.过氧乙酸溶液、b.1mol/L的FeCl3溶液、c.0.5mol/L的Fe2(SO4)3溶液、d.0.5mol/L的CuCl2溶液、e.1mol/L的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i.带导气管的试管。
你选择的试剂及器材是a、__、f
(6)碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mLNa2S2O3标准液。该样品中过氧乙酸的物质的量浓度是__mol/L。(结果保留小数点后两位)
提示:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g)![]() H2(g)+I2(g);则下列有关说法正确的是
H2(g)+I2(g);则下列有关说法正确的是
A. 如改变体系温度,体系颜色不一定发生变化
B. 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移
C. 继续充入HI气体,达到平衡后, 体系颜色加深
D. 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 组装该电池应当在无水、无氧的条件下进行
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
D. 充电时Cl移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A 是农药生产中的一种中间体,其结构简式如图:
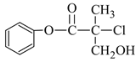
下列有关叙述中正确的是
A.l mo1 A和足量的H2发生加成反应,最多可以消耗4 mol H2
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粉反应是否生成CO,已知:CO能与银氨溶液反应产生黑色固体。实验装置如图所示:
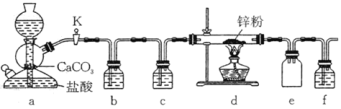
下列说法正确的是( )
A.实验开始时,先点酒精灯,后打开活塞K
B.b、c、f中试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
C.e装置作用是收集CO2
D.用上述装置可以制备氢气并探究氢气的还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com