
����Ŀ��Ԫ�����ڱ��е�VIIA��Ԫ�صĵ��ʼ��仯�������;�㷺��
(1)��Ԫ��ͬ�����һ����Ԫ�ص�ԭ�ӽṹʾ��ͼΪ_______������______ (����ɫ)�������ʡ�
(2)���ݵ���ʵ�������������ǻ���ʯ[Ca5(PO4)3OH]�ܽ�Ľ������մ���������ϣ���ø�������²����������ʣ������ȣ�ݡ�ʹ�ú�������ᱣ�����ݣ���Ϊ�����ӻ���ǻ���ʯ[Ca5(PO4)3OH]������Ӧ���ɷ���ʯ������ʯ���ǻ���ʯ���ֿܵ������ʴ���������ӷ���ʽ��ʾ��һ����___________�����������ӻ������ƿ�ǻϸ�������ᣬ�������༺���ձ�ʹ�á�
(3)�ⱻ��Ϊ������Ԫ�ء��������(KIO3)�ǹ��ҹ涨��ʳ�μӵ�������ľ���Ϊ��ɫ��������ˮ������������Խ�������⻯�����ɵ��ʵ⡣д���÷�Ӧ�����ӷ���ʽ_____________��
(4)������װ��KI��������Һ���м��������ӽ���Ĥ�������ڡ����ĵ�ѹ��ͨ�磬���������Һ����ɫ��һ��ʱ�����ɫ��dz�������ϣ��ӵ��Һ�еõ�����ؾ����ʵ��������£�
![]()
����ݵIJ�������____________________��
(5)��֪��I2+2S2O32-=S4O62-+2I-��
�á���ӵ��������ⶨ����CuCl2��2H2O�������������������I-������Ӧ�����������ʣ��Ĵ��ȣ��������£�ȡag��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ������I-������ΪI2��Ȼ����cmol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O5����ҺbmL����ѡ��______���ζ�ָʾ�����ζ��յ��������_______________��
���𰸡� +17287 �Ϻ�ɫ Ca5(PO4)3OH(s)+F-(aq) ![]() Ca5(PO4)3F(S)+OH-(aq) IO3-+5I-+6H+=3H2O+3I2 ���� ������Һ �����һ�����������ʱ����Һ��ɫ��ȥ��������ڲ��ָ�
Ca5(PO4)3F(S)+OH-(aq) IO3-+5I-+6H+=3H2O+3I2 ���� ������Һ �����һ�����������ʱ����Һ��ɫ��ȥ��������ڲ��ָ�
��������(1)��Ԫ��ͬ�����һ����Ԫ�ص�ԭ��Ϊ��ԭ�ӣ�ԭ������Ϊ35��ԭ�ӽṹʾ��ͼΪ ���ⵥ��Ϊ�Ϻ�ɫ���壻
���ⵥ��Ϊ�Ϻ�ɫ���壻
(2)����������ӻ���ǻ���ʯ[Ca5(PO4)3OH]������Ӧ���ɷ���ʯ��֪����Ӧ���ӷ���ʽΪCa5(PO4)3OH(S)+F- (aq)Ca5(PO4)3 F(S)+OH-(aq)��
(3)������������������Ӻ͵����ӷ���������Ӧ���ɵⵥ�ʣ����ӷ���ʽΪ��IO3-+5I-+6H+=3I2+3H2O��
(4)������Һ����������ķ����ǣ���ȴ�ᾧ��ϴ�Ӻ�ľ�����ˮ�֣�����Ҫ���и�����˺�õ��ľ��������������������ص����ʣ�Ϊ�õ��ϴ����ĵ���ؾ��壬����Ҫ����ϴ�ӣ��ݴ˿�֪����ݵIJ�������Ϊ������
(6)�������������������I2+2S2O32-�TS4O62-+2I-��֪����Na2S2O3����Һ�պý���ȫ����Ӧ����������ɫ�����ɫ�����Կ��Ե�����ָʾ��������������ɫ�����ɫ�Ұ���Ӳ��仯�ζ��ﵽ�յ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1-�嶡��ͱ�Ҫ�����Լ���ȡ1-��Ȳ����������Ⱥ����ķ�Ӧ������
��ȡ�� �ڼӳ� ����ȥ �ܼӾ�
A. �٢ۢ� B. �ۢڢ� C. �ۢڢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᡣ��Ӧԭ����
��֪���ױ����۵�Ϊ��95�棬�е�Ϊ110.6�棬�ӷ����ܶ�Ϊ0.866g/cm3��
��������۵�Ϊ122.4�棬��25���95������ˮ���ܽ�ȷֱ�Ϊ0.344g��6.8g��
���Ʊ���Ʒ����30.0mL�ױ���25.0mL 1mol/L���������Һ��100���·�Ӧ30min��װ����ͼ1��ʾ��

��1������A������Ϊ________��A�Ľ�ˮ��Ϊ___���a����b������֧�ܵ�������____________��
��2���ڱ�ʵ���У�������ƿ����ʵ��ݻ���____������ĸ����
A��50mL B��100mL C��250mL D��500mL
�������Ʒ����ͬѧ�����ͼ2���̷���ֲ�Ʒ������ͻ��ռױ���

��3���������������________���������ʵIJ��ᆳ�������һ���ᴿ����ɫҺ��ױ�����������������_________��
�����Ȳⶨ����ȡ1.220g��ɫ���壬���100mL�״���Һ��ȡ25.00mL��Һ����0.1000mol/LKOH����Һ�ζ����ظ��ζ��ĴΣ�ÿ�����ĵ���������ʾ��
��һ�� | �ڶ��� | ������ | ���Ĵ� | |
�����mL�� | 24.00 | 24.10 | 22.40 | 23.90 |
��4���ζ������У������װ��KOH����Һ�ĵζ��ܶ���ʱ���ζ�ǰ���ӣ��ζ�������ⶨ���______���ƫ����ƫС�����䡱����������Ʒ�б����ᴿ��Ϊ_________��
��5���Ӱ�ɫ����B�еõ������ı������ʵ�鷽���ǣ�____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������û�ѧƷ����ͪ���ᣨH2NCH2COCH2CH2COOH���������й�˵��������ǣ� ��
A. ����5�ֹ����� B. �������ԡ�����
C. ���Է���ȡ�����ӳɡ���ԭ��������Ӧ D. ������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ�ֹ�״�����м��塣�������ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·�����£�
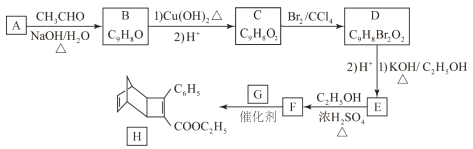
��֪����![]()
��![]()
�ش��������⣺
(1)A�Ļ�ѧ����ΪΪ__________��
(2)��C����D��D����E�ķ�Ӧ���ͷֱ�Ϊ__________��_________��
(3)E�Ľṹ��ʽΪ____________��
(4)��E����F�Ļ�ѧ����ʽΪ___________��
(5)���㻯����X��F��ͬ���칹�壬X���뱥��̼��������Һ��Ӧ�ų�CO2����˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6��2��2��1��д��2�ַ���Ҫ���X�Ľṹ��ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֡�
I.�о����֣�NOx����������Ҫ�ɷ�֮һ��NOx��Ҫ��Դ������β����
��֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180.50kJ��mol��1
2NO(g) ��H=+180.50kJ��mol��1
2CO(g)+O2(g)![]() 2CO2(g) ��H=��566.00 kJ��mol��1
2CO2(g) ��H=��566.00 kJ��mol��1
Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ _____________��
II.�������������Դ�ɼ�����Ⱦ������������⡣�״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����һ����������CO��H2�ϳ�CH3OH��CO(g)+2H2(g)![]() CH3OH(g)����2L�ܱ������г������ʵ���֮��Ϊ1:2��CO��H2���ڴ��������³�ַ�Ӧ��ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯����ͼ��ʾ��
CH3OH(g)����2L�ܱ������г������ʵ���֮��Ϊ1:2��CO��H2���ڴ��������³�ַ�Ӧ��ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯����ͼ��ʾ��

(1)�÷�Ӧ�ķ�Ӧ�ȡ�H _______ 0���������������ѹǿ����Դ�С��P1______P2���������������
(2)�÷�Ӧ��ѧƽ�ⳣ������ʽΪ___________��
(3)���и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ�����______________��
A.����������ѹǿ���ٱ仯 B.v(CO):v(H2):v(CH3OH)=1:2:1
C.�����ڵ��ܶȲ��ٱ仯 D.�����ڻ�������ƽ����Է����������ٱ仯
E.�����ڸ���ֵ������������ٱ仯
(4)ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��______(����ĸ)��
A.������Ӧ�����ƶ� B.���淴Ӧ�����ƶ� C.���ƶ�
III.����ȼ�շ�Ӧԭ�����ϳɵļ״����������ͼ��ʾ��ȼ�ϵ��װ�á�

(5)�����缫��ӦʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2)��һ�־�ϸ������Ʒ������һԪ���ᣬ���н�ǿ�Ļ�ԭ�ԡ������й�˵����ȷ������ ��
A. �ö��Ե缫���NaH2PO2��Һ����������ӦʽΪ��2H2O-4e- =O2��+4H+
B. H3PO2�����NaOH��Һ��Ӧ�����ӷ���ʽΪ��H3PO2+3OH-=PO23-+3H2O
C. ��H3PO2��Һ���뵽�����ظ������Һ�У�H3PO2�Ļ�ԭ�������ΪH3PO4
D. H3PO2����ˮ�ĵ��뷽��ʽΪH3PO2![]() H++ H2PO2-
H++ H2PO2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������2017�쿼ǰģ���̴�о�����3�ֲ�ͬ�����£��ֱ����ݻ�Ϊ2L�ĺ����ܱ������г���2 mol A��1 mol B��������Ӧ��2A(g) + B(g)![]() 2D(g) ��H=Q kJ��mol�C1��������������ݼ��±���
2D(g) ��H=Q kJ��mol�C1��������������ݼ��±���
ʵ���� | ʵ��� | ʵ��� | ʵ��� |
��Ӧ�¶�/�� | 700 | 700 | 750 |
��ƽ��ʱ��/min | 40 | 5 | 30 |
n(D)ƽ��/ mol | 1.5 | 1.5 | 1 |
��ѧƽ�ⳣ�� | K1 | K 2 | K 3 |
����˵����ȷ����
A��K 3��K 2��K 1
B��ʵ������ʹ���˴���
C��ʵ����ƽ��������ڵ�ѹǿ��ʵ����![]() ��
��
D��ʵ����ƽ�����������������ͨ��1 mol A��1 mol D��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ﲻ���ɵ���ֱ�ӻ��϶��ɵ���
A. FeCl3 B. CuS C. HCl D. Fe3O4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com