
【题目】铅及其化合物广泛用于蓄电池、机械制造、电缆护防等行业。
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_________;
(2)铅蓄电池是一种用途广泛的二次电池。铅蓄电池的电池反应通常表示如下:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。
2PbSO4 +2H2O。
铅蓄电池充电时,二氧化铅电极应与外接电源的_________________(填“正极”或“负极”)相连接,该电极的电极反应式为________________________________。
(3)利用电解法可制得金属铅。将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb,装置如下图所示。
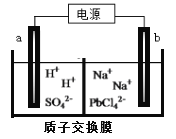
a电极的名称是__________,b电极的电极反应式为______________________
(4)PbO2可以通过石墨为电极电解Pb(NO3)2 和Cu(NO3)2的混合溶液制取。则阳极发生反应的电极反应式为______________,阴极上观察到的现象是____________。
【答案】 第六周期第ⅣA族 正极 PbSO4-2e-+2H2O=PbO2+4H++ SO42- 阳极 PbCl42-+2e-=Pb+4Cl- Pb2++2H2O-2e-=PbO2↓+ 4H+ 石墨上有红色铜析出
【解析】(1)C、Pb属于同一主族元素,Pb比C多4个电子层,则Pb含有6个电子层,则Pb位于第六周期第IVA族,故答案为:第六周期,第ⅣA族;
(2)铅蓄电池的电池反应为:Pb+PbO2+2H2SO4 ![]() 2PbSO4 +2H2O。放电时二氧化铅为正极,充电时,二氧化铅电极应与外接电源的正极相连接,充电时阳极的电极反应式为PbSO4-2e-+2H2O=PbO2+4H++ SO42-,故答案为:正极;PbSO4-2e-+2H2O=PbO2+4H++ SO42-;
2PbSO4 +2H2O。放电时二氧化铅为正极,充电时,二氧化铅电极应与外接电源的正极相连接,充电时阳极的电极反应式为PbSO4-2e-+2H2O=PbO2+4H++ SO42-,故答案为:正极;PbSO4-2e-+2H2O=PbO2+4H++ SO42-;
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含[PbC14]2-的电解液。用惰性电极电解Na2PbCl4溶液制得金属Pb。根据装置图,b电极上 [PbC14]2-发生还原反应得到金属Pb,b极为阴极,则a极为阳极,其中阴极的电极反应式为PbCl42-+2e-=Pb+4Cl-,故答案为:阳极;PbCl42-+2e-=Pb+4Cl-;
(4)阳极上Pb2+失去电子,得到PbO2,需要水参与反应,同时生成氢离子,电极反应式为:Pb2++2H2O-2e-=PbO2+4H+,阴极上,Cu2+获得电子生成Cu,附着在石墨电极上,即石墨上红色物质析出;故答案为:Pb2++2H2O-2e-=PbO2+4H+;石墨上红色物质析出。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】已知氧化性Fe3+>Cu2+>Fe2+ . 现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用1.2molL﹣1的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
组别 | ① | ② | ③ | ④ |
V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
混合粉末质量/g | 1.2 | 2.4 | 3.6 | 4.8 |
反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12[ |
分析表中数据,下列结论不正确的是( )
A.第①组反应后溶液中剩余c(Fe3+)=0.4 molL﹣1
B.第②、③组剩余固体全是铜
C.第④组的滤液中c(Fe2+)=2.0 molL﹣1
D.原混合粉末中n(Fe):n(Cu)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B. 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应: 4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH—+Cl2↑+H2↑
2OH—+Cl2↑+H2↑
D. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是
A. 定容到刻度线时要使视线与凹液面的最低处水平相切
B. 用蒸馏水洗涤容量瓶后必须将容量瓶烘干
C. 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
D. 定容时不小心加水过量,用胶头滴管将水吸出即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2Na2O2+2CO2==2Na2CO3+O2 的下列说法正确的是
A. CO2是还原剂,在该反应中被氧化
B. Na2O2是氧化剂,在该反应中发生氧化反应
C. 氧化剂和还原剂的物质的量之比为1∶2
D. 若有2 mol Na2O2参加反应,则有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH![]() 5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
A. 少吃甜食 B. 多喝碳酸饮料
C. 在牙膏中加入氟化物添加剂 D. 在牙膏中添加适量的Ca2+或PO43-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾的化学式可表示为FeSO4·xH2O,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的某些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加少量稀H2SO4后,再滴加KSCN溶液,溶液颜色无明显变化。充分振荡后,溶液逐渐变红。溶液变红的原因是_________(用离子方程式表示)。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①下列实验操作步骤的正确排序为___________________(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.关闭K1和K2 b.打开K1和K2,缓缓通入N2 c.点燃酒精灯,加热 d.称量A e.冷却到室温 f.熄灭酒精灯
②判断A是否恒重的方法是____________________。
③根据实验记录,绿矾化学式中结晶水数目x=________________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入由下图所示仪器组装而成的装置中,打开K1和K2,缓缓通入N2一段时间后,加热。实验后反应管中残留固体为红色粉末。
①反应中有两种气体产物生成,为检验该气体混合物的组成,请从下图所示的仪器中,选择合适的仪器(含其中的试剂),组成一套实验装置,该装置的连接顺序(按气体流向从左到右)依次为___________→D(填装置序号)。装置中除有气泡冒出外,其他证明实验结论的现象分别为__________________________。

②硫酸亚铁高温分解的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A. MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓
B. CO2 + 2NaOH == Na2CO3 + H2O
C. CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
D. 2H2+O2![]() 2H2O
2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com