
【题目】下列有关氯水的叙述中,不正确的是
A. 新制氯水呈黄绿色,且有刺激性气味,说明有Cl2分子存在
B. 新制氯水只能使紫色石蕊试纸变红
C. 新制氯水放置数天后酸性增强
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
【答案】BD
【解析】
氯气溶于水形成氯水,部分氯气与水发生反应为Cl2+H2OHCl+HClO,HClO![]() H++ClO-,次氯酸因其自身的强氧化性而具有漂白作用,且不稳定,光照下会分解,反应为2HClO
H++ClO-,次氯酸因其自身的强氧化性而具有漂白作用,且不稳定,光照下会分解,反应为2HClO![]() 2HCl+O2↑,再结合离子、分子的性质来分析作答。
2HCl+O2↑,再结合离子、分子的性质来分析作答。
A. Cl2为黄绿色,有刺激性气味,溶于水后部分氯气与水发生反应为Cl2+H2OHCl+HClO,因此新制氯水呈黄绿色,且有刺激性气味,说明有Cl2分子存在,故A项正确;
B.新制氯水中因含强氧化性的HClO而具有漂白性,因此新制氯水会使紫色石蕊试纸先变红后褪色,故B项错误;
C.氯水中HClO为弱酸且不稳定,见光易分解,反应为:2HClO![]() 2HCl+O2↑,因此新制氯水放置数天后酸性会增强,故C项正确;
2HCl+O2↑,因此新制氯水放置数天后酸性会增强,故C项正确;
D.因氯气可以与NaOH溶液反应,2NaOH+Cl2=NaCl+NaClO+H2O,因此加入NaOH溶液,氯水黄绿色消失,故D项错误;
答案选BD。


科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
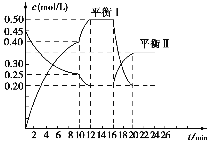
请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3 + CaCl2=CaCO3 ↓ + 2NaCl B. Cl2 + 2KI=2KCl + I2
C. 2NaHCO3 ![]() Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三锰(Mn3O4)是电子工业的磁性材料,而氯化铅(PbCl2)常用于焊料和助溶剂、制备其他铅盐等。用方铅矿精矿(主要成分为PbS)和软锰矿(主要成分是MnO2,还含有Fe2O3、Al2O3等杂质)制备PbCl2和Mn3O4的工艺流程如下:

已知:PbCl2(s) + 2Cl-(aq) ![]() PbCl42- ( aq) ΔH > 0
PbCl42- ( aq) ΔH > 0
(1)80℃时,为提高方铅矿精矿、软锰矿与盐酸反应的速率,可采取的措施有________(写出一条即可)。
(2)试剂X是___________。(填“化学式”)
(3)用盐酸处理两种矿石粉末,生成MnCl2、PbCl2和S的总反应化学方程式为___________。
(4)结合化学用语回答,向酸浸液中加入饱和食盐水的目的是___________。
(5)向滤液b中通入NH3和O2发生反应后,总反应的离子方程式为___________。
(6)金属锰可以用Mn3O4为原料,通过铝热反应来制备,当生成5.5 kg Mn 时,理论上消耗金属铝的质量最少为___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下面的烃的名称或结构简式:
(1) _________________________________,
_________________________________,
(2)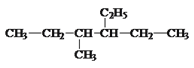 _______________________________,
_______________________________,
(3) __________________________________,
__________________________________,
(4)间甲基苯乙炔___________________________________,
(5)3-乙基-1-庚烯____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1NH3·H2O 溶液中有如下电离平衡:NH3·H2O ![]() NH4++OH- 对于该平衡,下列叙述正确的是
NH4++OH- 对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向逆反应方向移动
C.加入少量 0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质的电离方程式如下:
HClO4![]() H++ClO4-;
H++ClO4-;
Ba(OH)2![]() Ba2++2OH-;
Ba2++2OH-;
Fe2(SO4)3![]() 2Fe3++3SO42-;
2Fe3++3SO42-;
KHSO4![]() K++H++SO42-。
K++H++SO42-。
属于酸的物质是______(写化学式,下同);属于碱的物质是______;属于盐的物质是___________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是______。
②上述物质中既不是电解质也不是非电解质的是______。依据是__________。
③写出纯碱的电离方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的固定和利用对降低温室气体排放具有重要作用,CO2加氢合成甲醇不仅可以有效缓解减排压力,而且还是CO2综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。

(1)下列措施能使CO2的转化率提高的是__。
A. 增大压强 B.升高温度 C.增大投料比 D.加入更高效的催化剂
(2)在220℃、5.0MPa时,CO2、H2的转化率之比为______。
(3)将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将___(填“增大”“减小”或“不变”,下同),CO2的转化率将____。
(4)200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K=___ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com