
【题目】下列说法中,正确的是( )
A.向KI溶液中通入适量Cl2后,溶液颜色变深
B.向KCl溶液中滴加几滴酚酞试液,溶液颜色变红
C.溴水与NaCl溶液混合时,会发生置换反应
D.NaCl溶液在空气中会被氧化,故需要密封保存
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前36号元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,C原子基态时s电子数与p电子数相等,D在元素周期表的各元素中电负性最大,E的基态原子核外有6个能级且全部充满电子,F原子基态时未成对电子数是同周期元素中最多的。
(1)F元素的名称是________ ,基态F原子的价电子轨道表示式_________画出AC2的电子式_______________E元素常见离子的电子排布式______________。
(2)A、B、C的电负性大小顺序(填元素符号,下同)______________,第一电离能大小顺序为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
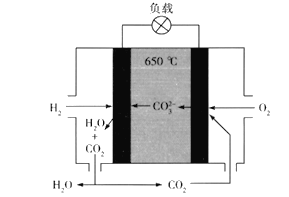
A. 电池工作时,熔融碳酸盐只起到导电的作用
B. 负极反应式为H2 -2e- +CO32-==CO2+H2O
C. 该电池可利用工厂中排出的CO2,减少温室气体的排放
D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是

A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2(g)+O2(g) 2SO3(g),达到平衡时: n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A. 1.2 mol B. 0.4 mol C. 0.8 mol D. 0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 将稀硫酸加入到大苏打溶液中:S2O32-+2H+=S↓+SO2↑+H2O
B. 用铁为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 用浓盐酸酸化的KMnO4溶液与H2C2O4反应,反应的离子方程式为:2MnO4—+6H++5H2C2O4=2Mn2+ +10CO2↑ +8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳有两种常见的同位素12C、13C;氧有三种常见的同位素16O、17O、18O.由这五种微粒构成的CO2分子中,其相对分子质量最多可能有( )
A.6种
B.10种
C.11种
D.12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com