

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
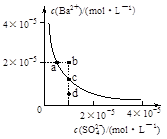
| A������Na2SO4����ʹ��Һ��a��䵽b�� |
| B��ͨ����������ʹ��Һ��d��䵽c�� |
| C��d����BaSO4�������� |
| D��a���Ӧ��BaSO4��Ksp����c���Ӧ��Ksp |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A����������Ũ�ȵ�����PbCl2������ܽ���ȱ�С���ֱ�� |
| B��PbCl2������0.50 mol/L�����е��ܽ��С���ڴ�ˮ�е��ܽ�� |
| C��PbCl2����Ũ���ᷴӦ����һ���ѵ����������(�������) |
| D��PbCl2��������ڱ���ʳ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ܽ�������ж����Mg(HCO3)2��Һ�õ��IJ�����Mg(OH)2������MgCO3 �� |
| B����pH�����Ʋⲻͬǿ����������ˮ��Һ��ˮ��̶ȵĴ�С�� |
| C���÷�Ӧ�����ݵĴ�С�жϲ�ͬ��Ӧ�ķ�Ӧ���ʵĿ����� |
| D����ƽ�ⳣ���Ĵ�С�жϻ�ѧ��Ӧ���ܽ��еij̶ȡ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��AgCl�������ɺͳ����ܽⲻ�Ͻ��У���������� |
| B���ڴ˱�����Һ�м�ˮ��KSP��AgCl������ |
| C���ڴ˱�����Һ�м�Ũ��Na2S��Һ�����ɺ�ɫ���� |
| D����AgCl������Һ�м���NaCl���壬c��Ag+������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 mAn+(aq)��nBm��(aq)��������[An+]m��[Bm��]n��Ksp
mAn+(aq)��nBm��(aq)��������[An+]m��[Bm��]n��Ksp�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������Ӽ������й��ۼ� | B�����ۼ� |
| C�����Ӽ� | D����ѧ��δ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a��b��c��d | B��d��b��c��a | C��a��d��b��c | D��c��b��d��a |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com