
【题目】已知正丁烷的二氯代物有6种同分异构体,则其八氯代物的同分异构体的数目为( )
A. 4种 B. 5种 C. 6种 D. 8种
科目:高中化学 来源: 题型:
【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质。
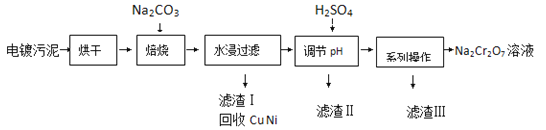
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如下表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为 ;水浸后溶液中除Na2CrO4还存在的溶质有 和 ;
(2)加入H2SO4调节pH的目的为 ;
(3)得到滤渣Ⅲ的“系列操作”的步骤为 、 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣,求转化后所得溶液中c(Cr2O72﹣) = molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色。乙醚中溶有CrO5,则发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. 组成它们的基本元素都是C、H、O、N
B. 它们的合成过程中都有水产生
C. 它们的结构及种类都具有物种特异性
D. 它们分子的多样性是细胞多样性的根本原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H202相似,熔点为l93 K,沸点为41lK,遇水很容易水解,产生的气体能使品红褪色,S2C12可由干燥的氯气通入熔融的硫中制得。下列有关说法正确的是( )
A.S2C12晶体中存在离子键和非极性共价键
B.S2C12分子中各原子均达到8电子稳定结构
C.S2C12在熔融状态下能导电
D.S2C12与水反应后生成的气体难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示
[已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1]:
2SO3(g) ΔH=-196.6 kJ·mol-1]:
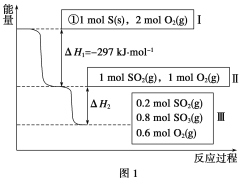
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:____________________。
(2)ΔH2=_____________________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为__________,若溶液中发生了氧化还原反应,则该过程的离子方程式为______________________。
(5)向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强p:p甲=p丙>2p乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
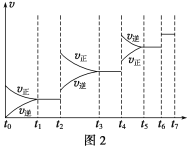
(7)各阶段平衡时对应的平衡常数如下表所示:
t1~t2 | t3~t4 | t5~t6 | t6~t7 |
K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是( )
A. 纯银器表面在空气中因电化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的反应热只与反应的始态和终态有关,而与具体反应进行的途径无 关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
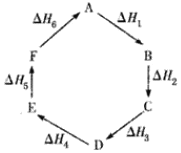
A.A→F:ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F:|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为 ,表中元素原子半径最小的是_________(填元素名称)。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a. Y单质与H2S溶液反应,溶液变浑浊
b. 在氧化还原反应中,1molY单质比1molS得电子多
c. Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为 。
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是 。
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式 ,该化合物中的化学键类型有 。
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com