
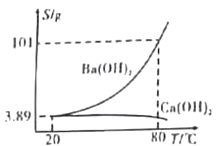
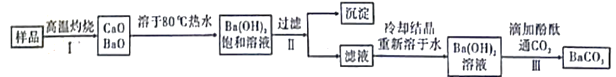
【题目】实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下[如图为Ba(OH)2和Ca(OH)2的溶解度曲线]:
下列有关说法错误的是
A.步骤Ⅰ所需主要仪器是酒精喷灯、铁坩埚、泥三角、玻璃棒等
B.步骤Ⅱ中过滤时的温度对实验无明显影响
C.步骤Ⅲ中,当观察到红色刚好消失时,即可停止通CO2
D.上述过程中涉及到分解、化合、复分解反应
【答案】B
【解析】
含碳酸钙杂质的碳酸钡样品经过高温灼烧,分解生成BaO、CaO,溶于80。C的热水中,生成Ba(OH)2的饱和溶液,Ca(OH)2的溶解度随温度升高而降低,此温度下Ca(OH)2的溶解度小得多,趁热过滤得到含少量Ca(OH)2的Ba(OH)2溶液,再经过冷却结晶,重新溶于水得到Ba(OH)2溶液,最后通入CO2,通过滴加酚酞确定反应进行的程度,从而得到碳酸钡,据此分析解答。
含碳酸钙杂质的碳酸钡样品经过高温灼烧,分解生成BaO、CaO,溶于80。C的热水中,生成Ba(OH)2的饱和溶液,Ca(OH)2的溶解度随温度升高而降低,此温度下Ca(OH)2的溶解度小得多,趁热过滤得到含少量Ca(OH)2的Ba(OH)2溶液,再经过冷却结晶,重新溶于水得到Ba(OH)2溶液,最后通入CO2,通过滴加酚酞确定反应进行的程度,从而得到碳酸钡。
A. 灼烧需要高温,所以选用酒精喷灯,碳酸钙、碳酸钡在高温下能与二氧化硅反应,所以不能用瓷坩埚,而用铁坩埚,铁坩埚置于泥三角上,灼烧时用玻璃棒搅拌使其受热均匀,A项正确;
B. 过滤的目的是分离Ba(OH)2和Ca(OH)2,根据溶解度曲线可知,Ca(OH)2的溶解度随温度升高而降低,则应趁热过滤,所以步骤Ⅱ中过滤时的温度对实验有影响,B项错误;
C. 当观察到红色刚好消失时,说明Ba(OH)2与CO2完全反应生成BaCO3沉淀,即可停止通CO2,C项正确;
D. 步骤I发生的是分解反应,BaO、CaO与水发生化合反应,Ba(OH)2与CO2发生的是复分解反应,D项正确;
答案选B。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
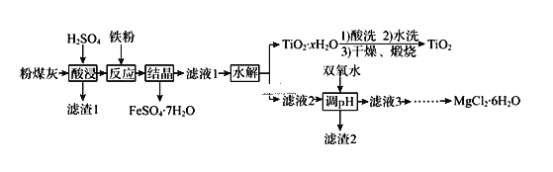
已知:①常温下,Ksp[Al(OH)3] ≈ 8.0×10-35;②滤液1中仍有Fe2+剩余③Fe3+完全沉淀时pH为3.7;Al3+完全沉淀时pH为5.0;Fe2+完全沉淀时pH为9.7;
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_________(任写两种)。
(2)怎样判断TiO2xH2O沉淀已经洗涤干净________________________________。
(3)加入双氧水的目的是_____________________________________。滤渣2中的成分分别为Al(OH)3和_______________,Al(OH)3沉淀完全时(溶液中离子浓度小于10-5mol/L),溶液中的c(OH-)为________。
(4)将MgCl26H2O制成无水MgCl2时应注意__________________________________。
(5)某同学以石墨为两个电极,电解MgCl2溶液以制取金属镁。你认为他能否获得成功?_______。用化学方程式解释原因___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是

A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力大于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)与α(HA-)不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼位于第ⅢA族,三氯化硼是无色、强烈臭味的发烟液体或气体,属于化学危险品,主要用于半导体硅的掺杂源、有机合成的催化剂,还应用于高纯硼、有机硼(如:乙硼烷B2H6)的制取。某同学设计利用Cl2和单质B制备三氯化硼(BCl3)的装置示意图。查阅资料:①BCl3沸点12.5℃,熔点-107.3℃,易潮解;②2B+6HCl![]() 2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
2BCl3↑+3H2↑;③硼与硅“对角线”相似,都能与氢氧化钠溶液反应。请回答下列问题:
(1)装置A中二氧化锰能与浓盐酸在加热条件下发生反应制取氯气,该反应的离子方程式:______________________________,洗气瓶G中用Na2SO3溶液除去Cl2反应的化学方程式是____________________________。
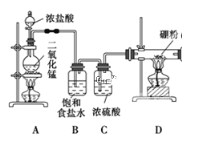
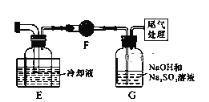
(2)E装置的作用是_________________________,如果拆去B装置,可能导致的后果是:_____________________________________________________________。
(3)写出D装置中发生反应的化学方程式:______________________________,实验中可用一个盛装__________(填:试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)BCl3遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应方程式:____________。
(5)为了顺利完成实验,正确的操作是____________(填:数字编号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②先点燃D处酒精灯,后点燃A处酒精灯③同时点燃A、D处酒精灯
(6)硼纤维是在金属丝上沉积无定形的硼而形成的无机纤维,通常在炽热的钨丝表面发生如下的反应:3H2+2BCl3 =2B+6HCl↑。要想验证制得的产品中是否含硼粉:应取少量样品于试管中,滴加浓____________(填:化学式)溶液,观察是否有气泡产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如下图所示,下列说法正确的是
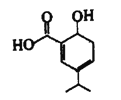
A. 分子式为C10H12O3 B. 能使酸性KMnO4溶液或溴水褪色
C. lmol该有机物可中和2molNaOH D. 1mol该有机物最多可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体(NaNO2),并对其进行纯度测定和相关性质的实验。
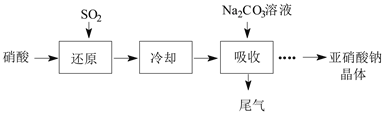
已知:Ⅰ.Na2CO3+NO+NO2=2NaNO2+CO2;Na2CO3+2NO2=NaNO2+NaNO3+CO2
Ⅱ.NaNO2是白色固体,易被氧化。
(1)“还原”步骤中被还原的元素是___(填元素符号)。此时SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___。
(2)若使“吸收”步骤中NOX完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___。
(3)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取2.000g样品,将其配成250mL溶液。
b.先向锥形瓶内加入40.00mL0.100mol·L-1的H2SO4溶液,加热至40~50℃。冷却后再向其中加入20.00mL0.100mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,重复三次,平均消耗样品溶液50.00mL。(NaNO2与KMnO4反应的关系式为:2KMnO4~5NaNO2)
①整个测定过程中应迅速操作,不宜耗时过长,否则样品的纯度___(“偏大”、“偏小”或“无影响”),原因是___。
②通过计算,该样品中NaNO2的质量分数是___,可能含有的杂质有___(写出其中一种即可)。
(4)该课外兴趣小组将NaNO2溶液逐滴加入到含淀粉KI的酸性溶液中,溶液变蓝,同时放出NO气体,该反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:3X(g)+Y(g)![]() 2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
2Z(g) ΔH>0。Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
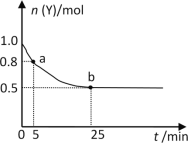
A.该反应为放热反应
B.0~5min内,以X表示的化学反应速率是0.02mol·L-1·min-1
C.b点时该反应达到了最大限度,反应停止
D.25min时,c(Z)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com