
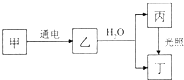
 甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).
甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).
| ||
| ||


科目:高中化学 来源: 题型:
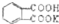 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:| 实验编号 | 邻苯二甲酸氢钾质量(g) | 待测NaOH溶液体积(mL) |
| l | 0.2040 | 23.20 |
| 2 | 0.2040 | 19.95 |
| 3 | 0.2040 | 20.05 |
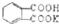 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、立方烷、棱晶烷和盆烯都不能使溴水褪色 |
| B、棱晶烷和盆烯互为同分异构体 |
| C、立方烷的二氯代物共有3种 |
| D、立方烷、棱晶烷中C原子都形成4个单键,因此它们都属于烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
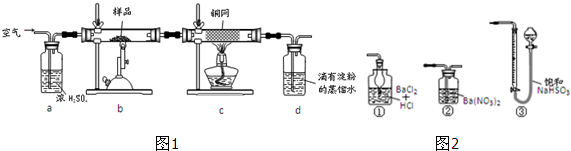
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
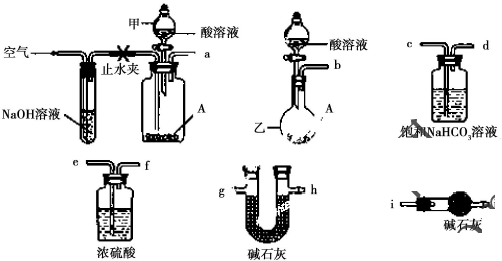
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
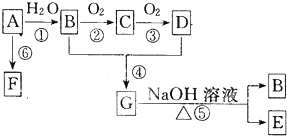
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com