
����Ŀ��ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã����������ʸߣ������Ѻã���δ����Դ����չ�ķ��� 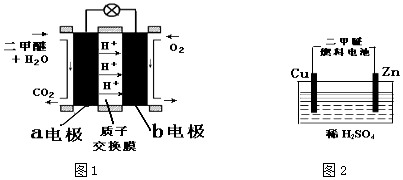
��1��ͼ1��Ϊ��ɫ��Դ�������ѡ���CH3��2O��ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ����ع���ʱ���������������� �������·����������a��b������a�缫�Ϸ�����Ӧ�ĵ缫��ӦʽΪ ��
��2������ͼ2װ�õĵ�ԴΪ��1�����еĶ�����ȼ�ϵ�أ���ͨ��Դһ��ʱ��۲쵽װ���е������Һ��ɫ����ɫ��Ϊ��ɫ����������װ���е�Cu�缫Ӧ�������ȼ�ϵ���� �缫����a��b��������ͨ��ʱ������Ӧ���ܵ����ӷ�Ӧ����ʽΪ���������缫���϶���Ϊʯī���������Һ��ΪMnSO4��Һ�����Ʊ�MnO2����������ӦʽΪ�������������23�ˣ��������ϲ���MnO2������Ϊ �ˣ�
���𰸡�
��1��b�� CH3OCH3��12e��+3H2O=2CO2+12H+
��2��b�� Cu+2H+![]() =Cu2++H2����261
=Cu2++H2����261
���������⣺��1����Ӧ�����Ƕ����ѵ�ȼ�գ�ԭ��ض������ڸ�������������Ӧ������������������ԭ��Ӧ�����Ե����ɸ���a�������·������b����ͼ��֪��a�������ѷŵ����ɶ�����̼�������ӣ�a�缫�ĵ缫��ӦʽΪ CH3OCH3��12e��+3H2O=2CO2+12H+��
�ʴ�Ϊ��a��b��CH3OCH3��12e��+3H2O=2CO2+12H+����2���������Һ��ɫ����ɫ��Ϊ��ɫ����˵��ͭ����������ͭΪ���ص�������Ӧ���ӵ�Դ����������b����������������������ͨ��ʱ������Ӧ���ܵ����ӷ�Ӧ����ʽΪCu+2H+ ![]() Cu2++H2����
Cu2++H2����
�����缫���϶���Ϊʯī���������Һ��ΪMnSO4��Һ�����Ʊ�MnO2��������Mn2+�ŵ緢��������Ӧ������MnO2���缫��ӦʽΪ��Mn2+��2e��+2H20=MnO2+4H+�����ݵ�·��ת�Ƶ�������ȣ�����CH3OCH3��12e����6MnO2�����Զ���������23�ˣ��������ϲ���MnO2������Ϊ ![]() ��6��87=261g��
��6��87=261g��
�ʴ�Ϊ��b�� Cu+2H+ ![]() Cu2++H2����Mn2+��2e��+2H20=MnO2+4H+��261��
Cu2++H2����Mn2+��2e��+2H20=MnO2+4H+��261��
��1��ͼ1��Ϊ��ɫ��Դ�������ѡ���CH3��2O��ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a�缫Ϊȼ�ϵ�صĸ���������������Ӧ��b�缫Ϊ������ص�������������ԭ��Ӧ�������ɸ���������������2���������Һ��ɫ����ɫ��Ϊ��ɫ����˵��ͭ����������������Ӧ����ͭΪ���ص����������Դ��������������п��Ϊ�����ӵõ��ӷ�����ԭ��Ӧ�������缫���϶���Ϊʯī���������Һ��ΪMnSO4��Һ�����Ʊ�MnO2��������Mn2+�ŵ緢��������Ӧ������MnO2�����ݵ�·��ת�Ƶ�������ȼ��㣬�Դ˽��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ������ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱN�缫���������٣���ش��������⣺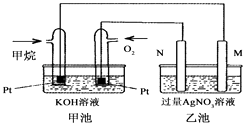
��1��M�缫�IJ����� �� ��缫��ӦʽΪ��N�ĵ缫������ �� �缫��ӦʽΪ��
��2��ͨ�����IJ��缫�ĵ缫��ӦʽΪ ��
��3���ڴ˹����У��ҳ���ijһ�缫����������4.32gʱ���׳�����������������Ϊ L����״���£���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ⷴӦ������ ![]() �����л��������
������������
A. ��ȩ��ͬϵ�� B. ��ȩ��ͬ���칹��
C. ������ͬϵ�� D. ������ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե���ʵ���������ȷ���ǣ� ��
A.����ˮ��õ�����Һ�ܵ���������ǵ����
B.����״̬�²��ܵ���Ļ�����һ�����ǵ����
C.��ˮ��Һ�л�����״̬���ܵ���Ļ������ǵ����
D.������ˮ�������ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ����뺬���Ļ�����ɲ��������������ơ����г���һ�ֳ����IJ���ҩƷ����˵���鲿������ժ¼���£� �����ÿƬ������������0.1g
����Ӧ֢������ȱ����ƶѪ֢��Ԥ���������ã�
�����ء��ܹ⡢�ܷ⡢�ڸ��ﴦ���森
��ҩ������á���ά����Cͬ���������ӱ�Ʒ���գ���ҩƬ��ˮ���Ҵ����ܽ�Ȳ���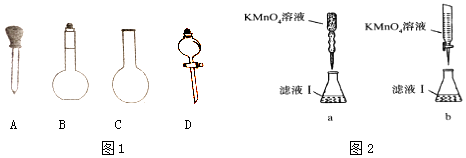
��ҩƷ��Fe2+�Ỻ�����������ҹ涨��ҩ����Fe2+�������ʣ��Ѿ�������Fe2+��������Fe2+�������ı�ֵ������10.00% �������ٷ��ã�
��1��ʵ���ҿɲ���H2SO4�ữ��KMnO4��Һ���ԡ������ơ��е�Fe2+���еζ�������ҩƷ�������ɷݲ���KMnO4��Ӧ�����ζ����̷������·�Ӧ���벹�������� Fe2++MnO4��+=Mn2+++ ��
��2��ʵ��ǰ����������Ԫ����������Ϊ20.00%�ġ������ơ�20.0g������ȫ������ϡH2SO4�У����Ƴ�250ml��Һ������ʱͼ1���������϶�����Ҫ���� �� �������ƣ�
��3��ȡ���ƺõ���Һ20.00ml����ƿ�У���0.1000mol/L��1��KMnO4��Һ�ζ���ijͬѧ�����ͼ2�ζ���ʽ���гֲ�����ȥ�������������������ĸ��ţ������ζ������У���ƿ�д���Һ�ɽ�������������Fe2+������������ƫ�ߡ�ƫ�ͻ䣩��
��4�����β����������£�
��� | V�� | Vĩ | V�� |
�� | 0.10mL | 9.71mL | 9.61mL |
�� | 1.50mL | 11.09mL | 9.59mL |
�� | 0.50mL | 11.10mL | 11.60mL |
����á������ơ�����ҩƷFe2+��������Ϊ%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӡ�m��p��r������ЩԪ����ɵĶ�Ԫ�����m�ڳ�����Ϊ��ɫ��ζ��Һ�壬n��Ԫ��z�ĵ��ʣ�ͨ��Ϊ����ɫ���塣r��ҺΪ������һԪǿ�ᣬp���ӵĿռ乹��Ϊ�������壬sͨ����������ˮ�Ļ����������ʵ�ת����ϵ��ͼ��ʾ��
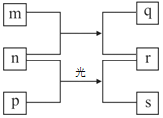
(1)Y�γɵļ������ӽṹʾ��ͼΪ_________��
(2)n�ĵ���ʽΪ_________��
(3)���о�q��һ����;________��
(4)W��X��Yԭ�Ӱ뾶���ɴ�С��˳��Ϊ_______(��Ԫ�ط��ű�ʾ)��
(5)д��n��p��һ����Ӧ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�����ڱ���������ȷ����
A. ���ڱ�����8��A�壬8��B��
B. Ŀǰʹ�õ�Ԫ�����ڱ��У�������ں���32��Ԫ��
C. ������Ԫ����ָ1-20��Ԫ��
D. ԭ�Ӽ������ӵĺ�����Ӳ��������ڸ�Ԫ�����ڵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����������ıʼDZ��������õļ״�ȼ�ϵ�صĽṹʾ��ͼ���״��ڴ����������ṩ����(H+)�͵��ӣ����Ӿ����·�����Ӿ��ڵ�·������һ����������Ӧ������ܷ�ӦʽΪ2CH3OH+3O2===2CO2+4H2O������˵���в���ȷ����

A. ��ߵĵ缫Ϊ��صĸ�����a��ͨ����Ǽ״�
B. ÿ����3.2 g����ת�Ƶĵ���Ϊ0.4 mol
C. ��ظ����ķ�ӦʽΪCH3OH+H2O6e===CO2+6H+
D. ��ص�������ӦʽΪO2+2H2O+4e===4OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩһ����ʹ��ѧ��Ӧ���ʽ��͵��ǣ� ��
A.����Ӧ���Ũ��
B.ʹ�ô���
C.�����¶�
D.����״�����ɷ�ĩ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com