
下列不能达到实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
科目:高中化学 来源: 题型:实验题
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: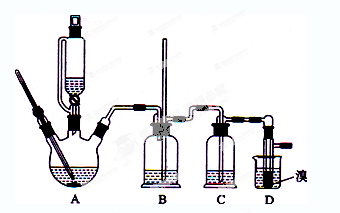
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验装置(部分固定装置略去)和有关叙述正确的是
| A.图1可以进行酸碱中和滴定实验 |
| B.图2可以进行中和热的测定实验 |
| C.图3可验证温度对化学平衡的影响 |
| D.图4可检验食盐水通电后的部分产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |  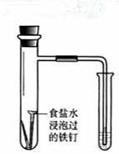 食盐水 |  片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 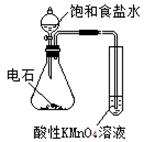 | 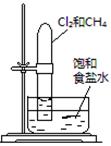 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是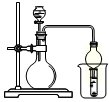
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下三种测定方法。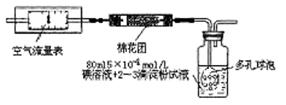
I.氧化还原法:甲同学根据化学反应原理SO2+I2+2H2O=H2SO4+2HI设计了如下图所示的装置进行实验:
(1)该实验需80ml浓度为5×10-4mol/L的碘
溶液,甲同学应选择 ml的容量瓶进行配制。
(2)广口瓶中使用多孔球泡的目的是 。
(3)在甲同学所配碘溶液浓度准确,并且量取药品及 实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因(至少写两种原因)
II.重量法:乙同学拟用实验室常用仪器组成简易装置测定空气中的SO2含量。实验操作过下:
按如下实验装置图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20ml的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀(H2SO4+BaCl2=BaSO4↓+2HCl),经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.18mg。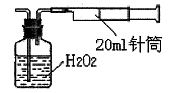
(4)取样处空气中SO2含量为 mg/L(精确到0.001)。
(5)现查阅资料知,常温下BaSO3的Ksp为5.48×10-7,饱和亚硫酸溶液中c(SO32-)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.lmol/L BaCl2溶液来吸收SO2即可产生沉淀,你认为这样做 (填“正确”或“不正确”),请利用以上数据简述理由 。
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4。
(6)请写出该电池负极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。 
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 .稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。方案I中过氧化镁的质量分数为 (用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为 (用含V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于各实验装置图的叙述中正确的是( )

| A.装置①:构成锌—铜原电池 |
| B.装置②:除去Cl2中含有的少量HCl |
| C.装置③:验证溴乙烷发生消去反应生成烯烃 |
| D.装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各实验装置图的叙述中,正确的是( )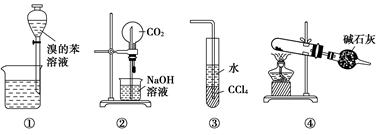
| A.装置①为放出萃取溴水后的苯层 |
| B.装置②为喷泉实验 |
| C.装置③可用来吸收HCl气体 |
| D.以NH4Cl为原料,装置④可用于制备少量NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com